Механизмы анти-старения и увеличения срока жизни, связанные с ограничением калорий: данные исследований генетически модифицированных животных.
Хорошо известно, что ограничение калорийности (сalorie restriction, CR) увеличивает продолжительность жизни и подавляет различные патофизиологические изменения. CR подавляет передачу сигналов гормона роста / инсулиноподобного фактора роста и mTORC1, активирует сиртуин и усиливает митохондриальную окислительно-восстановительную регуляцию. Но точные механизмы находятся в стадии обсуждения. В этом обзоре мы обсудим механизмы CR, используя данные исследований животных, которые были генетически модифицированы в соответствии с недавними достижениями в молекулярных и генетических технологиях, с точки зрения гипотезы адаптивного ответа, предложенной Холлидей в1989 году. Также мы объясним положительные действия CR, классифицированные в зависимости от того, действуют ли они в условиях питания или голодания.
Введение
В 1935 году было описано, что CR увеличивает продолжительность жизни у крыс [ 1 ]. CR, также известное как диетическое ограничение или ограничение энергии, широко применяется в исследованиях старения как сильная и просто воспроизводимая диетическая манипуляция для продления срока жизни. Действие CR наблюдалось у нескольких видов, от дрожжей и нематод до млекопитающих. У млекопитающих оно в основном изучалось с использованием грызунов, у которых CR подавляет различные возрастные патофизиологические изменения и продлевает средний и максимальный срок жизни. Однако полезные действия CR исчезают в определенных штаммах и / или состояниях. Недавний обзор подробно описывает эти ограничения [ 2 ]. Степень, в которой CR оказывает благоприятные эффекты, зависит от таких факторов, как виды грызунов, штаммы и сроки начала CR. В целом, однако, долгосрочное CR, начатое в молодом возраста подавляет возрастные патофизиологические изменения и продлевает долговечность у разных грызунов. Важно также, что ограничения отдельных питательных веществ (например, глюкозы, липида, белка) без ограничения энергии не вызывают таких благоприятных эффектов [ 3, 4 ].
Более 20 лет назад было обнаружено, что мыши-карлики Ames, которые имеют мутацию гена Prop1, живут дольше, чем мыши дикого типа [ 5 ]. Это был первый отчет о том, что одна мутация гена или генетическая модификация способна продлить долговечность у млекопитающих. По нашим сведениям, более 40 мышей и крыс с единственной генной мутацией или генетической модификацией живут дольше, чем животные дикого типа. Из этих мышей и крыс примерно одна треть демонстрирует подавленный сигналинг гормона роста (GH) / инсулиноподобный фактор роста 1 (IGF1). Поскольку CR также подавляет сигналинг GH / IGF1, полезные действия CR могут быть основаны на этом. Другие молекулярные механизмы, которые были предложены для регулирования полезных действий CR, включают подавление активности механистической мишени рапамицинового комплекса 1 (mTORC1), активацию аутофагии, активацию метаболизма НАД + и сиртуина и повышение редокс-регуляции митохондрий [6, 7 ]. Однако эти механизмы не полностью понятны.
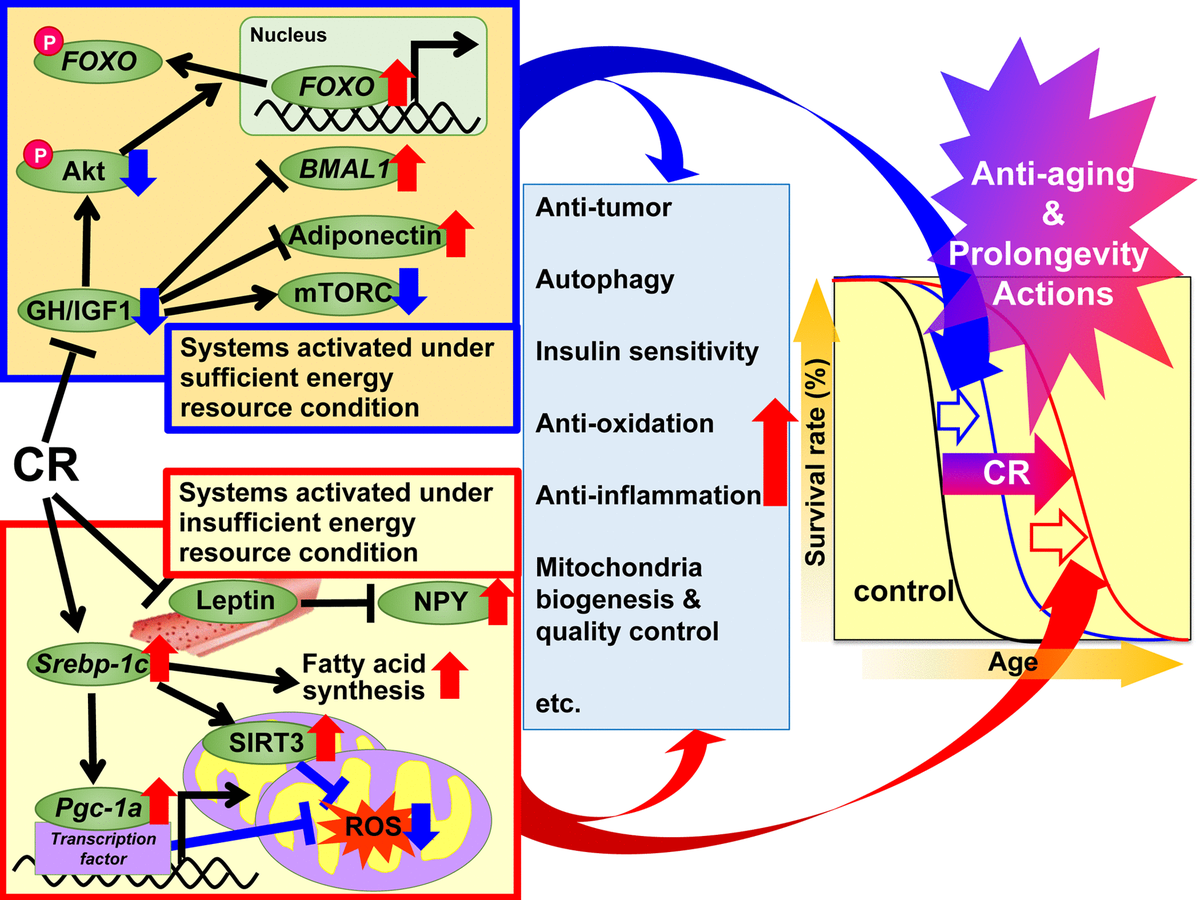
Рис.1. Предлагаемые механизмы действия калорийного ограничения (CR) против старения и по увеличению срока жизни на основе гипотезы адаптивного ответа. Предлагается, чтобы регуляторные механизмы CR были разделены на две системы. Первая система активируется при достаточных условиях энергоресурсов, когда есть возможность для свободного использования энергии, а животные хорошо растут, воспроизводят больше и сохраняют избыточную энергию в виде триглицеридов (ТГ) в белой жировой ткани (WAT) для последующего использования. Эта система включает в себя гормон роста (GH) / инсулиноподобный фактор роста 1 (IGF1), Akt, FOXO, mTORC, адипонектин и BMAL1. Вторая система активируется в условиях недостаточного энергоресурса, когда нет никакой пользы от излишнего использования энергии, а животные подавляют рост и размножение и используют сэкономленную энергию для поддержания биологической функции. Эта система включает в себя такие сигнальные пути: белок SREBP-1c, сиртуин (SIRT), белок PGC-1α, митохондриальные реактивные формы кислорода (ROS), лептин и нейропептид Y (NPY ).. У животных при CR эти сигналы действуют эффективно для использования энергии. Более того, различные сигналы и / или факторы могут способствовать благоприятным действиям, связанным с CR, включая антиоксидантные, противовоспалительные, противоопухолевые и другие действия CR в различной степени в каждой ткани или органе и тем самым привести к омоложению и увеличению срока жизни. .
Цели и молекулярные механизмы CR.
GH, IGF1 и FOXO1 сигналинг.
GH положительно регулирует продукцию IGF1 преимущественно в печени через GH-рецептор (GHR). IGF1 действует на рецептор IGF1, а затем фосфорилирует Akt, серин / треонинкиназу в клетках-мишенях. Затем фосфорилированная форма Akt фосфорилирует транскрипционные факторы FOXO, способствуя ядерному экспорту. Следовательно, подавление передачи сигналов GH / IGF1 транскрипционно повышает экспрессию нескольких генов, активированных факторами транскрипции FOXO.
Несколько модифицированных видов мышей, Ames dwarf, Snell dwarf и GHR knockout (GHR KO), показывают подавленную передачу сигналов GH и имеют увеличенную продолжительность жизни. У этих карликовых мышей сходные фенотипы с мышами CR, включая подавляемую сигнализацию GH / IGF1, сниженные уровни гормона щитовидной железы, инсулина и глюкозы, более низкая температура тела и снижение ожирения. Однако профиль экспрессии генов печени значительно отличается между мышами GHR KO и мышами CR [ 8 ]. Мы также сообщали, что часть профиля экспрессии генов в белой жировой ткани (WAT) крыс CR значительно отличается от таковой у крыс lifelong dwarf, несущих антисмысловый трансген GH [ 9 ].
Bonkowski et al. сообщили, что CR повышает чувствительность к инсулину и увеличивает продолжительность жизни у мышей дикого типа, но не у мышей GHR KO [10]. Поэтому они предположили, что действие увеличения срока жизни CR зависит от подавления передачи сигналов GH / IGF1. У карликовых мышей и карликовых крыс, несущих антисмысловый GH трансген, CR еще больше увеличил продолжительность жизни [ 11, 12 ]. Эти данные свидетельствуют о том, что действия против старения и по увеличению продолжительности жизни CR могут регулироваться как зависимым от сигнала GH / IGF1, так и независимо.
Факторы транскрипции FOXO у млекопитающих состоят из четырех изоформ, то есть FOXO1, 3, 4 и 6. У мышей FOXO1 KO (с нокаутом этого гена) увеличенный срок службы CR, но не было противоопухолевого эффекта, связанного с CR [ 13 ]. И наоборот, у мышей FOXO3 KO добавление CR подавляло опухолегенез, но не было CR-индуцированного увеличения продолжительности жизни [ 14 ]. Эти различия могут быть связаны с дифференциальной активационной картиной в тканях и / или клетках четырех изоформ факторов транскрипции FOXO, индуцированных CR.
Белок BMAL1 является транскрипционным фактором, участвующим в регуляции циркадного ритма. У мышей BMAL1 KO (с нокаутом этого гена) потребление пищи увеличивалось, масса тела снижалась, а фенотипы старения ускорялись. У этих же мышей CR не понижал уровни инсулина и IGF1 и не увеличивал продолжительность жизни. Что показывает на участие BMAL1 в полезном действии CR и что это полезное действие зависит от передачи сигналов GH / IGF1 [ 15 ].
Сигнализация mTOR.
mTOR киназа, серин / треонинкиназа, была идентифицирована как молекула-мишень рапамицина. Она образует два отдельных мультибелковых комплекса, известных как mTORC1 и mTORC2. Известно, что mTORC1 активируется аминокислотами и факторами роста (например, инсулином и IGF1). Активация mTORC1 способствует синтезу белка через рибосомальную протеинкиназу S6 1, синтез жирных кислот через стероидный регулятор-связывающий белок (SREBP) 1 и дифференцировку адипоцитов с помощью рецепторов, активируемых пероксисомными пролифераторами (PPARγ). mTORC1 подавляет аутофагию и лизосомальный биосинтез через фактор транскрипции EB (TFEB). Функция же mTORC2 плохо понятна, но считается, что она включает в себя усиление анаболических действий и подавление катаболических действий, как и для mTORC1 [ 16 ].
Мыши, которым давали рапамицин, отрицательно регулирующий mTORC1, в течение длительного периода после среднего возраста, имели увеличение продолжительности жизни [ 17 ]. В соответствии с этим обнаружением трансгенные мыши с избыточной экспрессией белка TSC1, который отрицательно регулирует mTORC1, живут дольше, чем мыши дикого типа [ 18 ]. Кроме того, мыши с нокаутом рибосомальную протеинкиназу S6 1 и мутантные мыши mTOR также жили дольше, чем мыши дикого типа [ 19, 20 ].
Насколько нам известно, полезное действие CR еще не изучалось у мышей с дефектной функцией mTORC1. Однако у дрожжей с генетическим ингибированием mTOR CR не увеличивал продолжительность жизни [ 21 ]. Аутофагия усиливается подавлением mTORC1. В нематодах, дефицитных генами, связанными с аутофагией, CR не увеличивал продолжительность жизни [ 22 ]. Исходя из этих данных, вероятно, что снижение активности mTOR и активация аутофагического аппарата связаны с положительным эффектом CR.
Сиртуины.
Sir2 был обнаружен как новый ген, участвующий в подавлении транскрипции у дрожжей. После этого было сообщено, что он играет ключевую роль в продлении жизни при CR [23, 24]. Семь генов-ортологов sirtuin, сиртуины Sirt1 — Sirt7, были идентифицированы у млекопитающих. Белки SIRT1, 6 и 7 в основном локализуются в ядре, SIRT2 в ядре и цитоплазме, а SIRT 3, 4 и 5 преимущественно в митохондриях. Сиртуины катализируют реакции деацетилирования различных белков, включая гистоны, в зависимости от НАД [ 25 ].
Среди семи сиртуинов млекопитающих сообщается, что SIRT1, 3 и 6 участвуют в возрастной патофизиологии и регуляции срока жизни [ 26 ]. Трансгенные мыши, у которых белок SIRT1 избирательно избыточно экспрессировался в гипоталамических нейронах, имели более длительный срок жизни, чем мыши дикого типа. [ 27 ]. Трансгенные мыши-самки, у которых белок SIRT6 был сверхэкспрессирован, имели более длительный срок службы, чем мыши дикого типа [ 28 ]. У пожилых мышей CR в течение 6 месяцев повышала экспрессию SIRT6 и улучшала почечную недостаточность. Кроме того, в то время как избыточная экспрессия SIRT6 подавляла клеточное старение посредством снижения активности связанного с воспалением фактора транскрипции NF-κB, нокаут SIKT6 ускорял клеточное старение [ 29 ]. У мышей SIRT3 KO раньше отмечались различные возрастные патологии [ 30 ]. Хотя CR предотвращала возрастную потерю слуха у мышей дикого типа, этот эффект не наблюдался у мышей SIRT3 KO [ 31 ].
Транскрипционный фактор NRF2.
NRF2 связывается с элементами антиоксидантного ответа, чтобы индуцировать экспрессию генов-мишеней в ответ на окислительный стресс и усиливает экспрессию генов, участвующих в на антиоксидантных и детоксикационных ответах. В физиологических условиях NRF2 связывается с белком Keap1 в цитоплазме, где он деградирует. В условиях стресса, включая окислительный стресс, после того, как Keap1 захватывается фосфорилированным p62, NRF2 транслоцируется в ядро, связывается с антиоксидантными элементами ответа и активирует транскрипцию антиоксидантных генов [ 32 ].
Поскольку экспрессия NRF2 уменьшается со старением у грызунов, предполагается, что уровни реактивных форм кислорода и различные риски возникновения рака увеличиваются. Тем не менее, CR подавляет возрастное снижение антиоксидантной способности за счет увеличения экспрессии генов, участвующих в антиоксидации и детоксикации. В нематодах Skn-1, гомолог NRF2, незаменим для действия CR по увеличению срока жизни. Мыши с нокаутом NRF2 демонстрируют снижение экспрессии генов, участвующих в антиоксидантном ответе и детоксикации, в результате чего ускоряется онкогенез. Роль NRF2 в полезных действиях CR была исследована с использованием мышей NRF2 KO. Результаты показали, что NRF2 имеет важное значение для противоопухолевого действия CR, но не участвует в эффектах, связанных с продолжительностью жизни и повышением чувствительности к инсулину CR [33].
Нейропептид Y (NPY).
У млекопитающих нейроны в гипоталамическом дугообразном ядре чувствуют энергетический статус от уровней циркуляции гормонов. CR-ассоциированный отрицательный энергетический баланс и последующее уменьшение жировой массы увеличивает циркуляцию уровней грелина и адипонектина и снижает уровни лептина, инсулина и IGF1 в крови. Эти гормональные изменения активируют NPY-нейроны в гипоталамическом дугообразном ядре. Большинство этих нейронов синтезируют белок Agrp, ослабляя активность POMC-нейронов в дугообразном ядре. Изменение активности первичных нейронов ингибирует вторичные гипоталамические нейроны, секретирующие соматотропин, гонадотропин и тиреотропин-рилизинг гормон, и активирует нейроны, секретирующие кортикотропин-рилизинг гормон. Это гипоталамическое изменение подавляет передачу сигналов GH / IGF1, функцию щитовидной железы и репродукцию и активирует функцию глюкокортикоидов надпочечников. Большинство этих измененных профилей секреции нейронов наблюдаются у мышей и крыс при CR [ 34 ].
У нокаутированных мышей NPY KO добавление CR не увеличивало продолжительность жизни, вызывала толерантность к окислительному стрессу в печени и изменяла профиль секреции нейронов. Тем не менее, CR уменьшало уровень инсулина и IGF1 в крови, повышало уровень адипонектина в крови и уровень кортикостерона и уменьшало экспрессию генов, участвующих в бета-окислении в печени. Таким образом, NPY должен быть ключевым фактором, связанным с независимыми от GF / IGF1 полезными действиями CR [35].
Мутация митохондриальной ДНК (мтДНК).
Принято считать, что накопление мутаций мтДНК является одним из ключевых факторов патогенеза в возрастных заболеваниях. Мыши PolgA D257A / D257A несут мутацию в мтДНК-полимеразе-гамма и показывают более раннее развитие возрастного накопления мутаций мтДНК и возрастных фенотипов в различных тканях [ 36 ]. У мышей PolgA D257A / D257A CR не продлевала продолжительность жизни, не влияла на накопление mtDNA-делеции в скелетных мышцах и не улучшала сердечную функцию, и это способствовало саркопении. Эти данные свидетельствуют о том, что накопление мутаций мтДНК может ингибировать полезные действия CR [37].
Наши новые результаты: ремоделирование жировой ткани под влиянием CR
Висцеральное ожирение, связанное с диабетом, гиперлипидемией и гипертонией, известное в совокупности как «метаболический синдром», является известным фактором риска развития атеросклеротических заболеваний, связанных с развитием жизни, включая инфаркт миокарда и инфаркт головного . Жировая ткань, первоначально считавшаяся только связанной с энергетической функцией, недавно описана как эндокринный орган, выделяющий различные биологически активные молекулы, называемые адипокинами. Большие адипоциты, которые накапливают триглицериды (ТГ) чрезмерно, увеличивают секрецию воспалительных адипокинов, включая фактор некроза опухоли-α (TNF-α) и интерлейкин-6 (IL-6), и уменьшают секрецию адипонектина по сравнению с малыми адипоцитами, которые накапливают меньше ТГ. Эти профили секреции адипокина непосредственно участвуют в возрастных патологиях, включая резистентность к инсулину, гипертонию и атеросклероз [ 38 ]. Кроме того, недавно сообщалось, что жировая ткань и адипокины являются ключевыми игроками в регулировании продолжительности жизни. Например, мыши с нокаутом рецептора инсулина в адипоцитах показали снижение ожирения, увеличение биогенеза митохондрий и более длительный срок жизни, чем мыши дикого типа [ 39 ]. Трансгенные мыши с избыточной экспрессией адипонектина в печени показали большую выживаемость, чем контроль [ 40 ]. Факторы транскрипции PPARγ и CCAAT / энхансер-связывающие белки α (C / EBPα) и β (C / EBPβ) участвуют в дифференцировке адипоцитов. Мыши с декомпозицией гена C / EBPβ в локусе C / EBP показали усиленный биогенез митохондрий и более длительные сроки жизни [ 41 ]. Напротив, у нокаутированных мышей PPARγ KO были более короткие сроки жизни, чем у контрольных [ 42 ].
Сообщается, что CR увеличивает активную форму адипонектина у мышей любого возраста. Эта CR-ассоциированная регуляция адипонектина зависит от передачи сигналов GH / IGF1 [ 43, 44 ]. Мы проанализировали CR-ассоциированное изменение в хронологическом порядке и получили следующие результаты. CR повышала экспрессию генов и / или белков, участвующих в биосинтезе жирных кислот (FA) и биогенезе митохондрий в жировой ткани после ранней фазы CR. Связанное с CR изменение происходило более преимущественно в жировой ткани, чем в других тканях или органах. После этого произошли морфологические изменения, включая уменьшение размеров адипоцитов и метаболические изменения в печени [ 45 ]. Чтобы прояснить связанные с CR метаболические изменения в жировой ткани, которые возникали независимо от сигнала GH / IGF1, мы затем сравнили профиль экспрессии генов при CR в жировой ткани крыс дикого типа с трансгенными крысами, которым давали ad libitum (AL ). Наши результаты показали, что CR усиливает экспрессию генов, участвующих в биосинтезе жирных кислот, в частности, у основного транскрипционного фактора биосинтеза жирных кислот, регуляторных генов SREBP-1, независимо от GH / IGF1 [ 9 ].
Поэтому мы затем сравнили эффект CR с различными параметрами, включая продолжительность жизни между нокаутированными мышами SREBP-1c KO и мышами дикого типа. Мыши SREBP-1c KO имели немного более короткие сроки жизни, чем мыши дикого типа. У мышей дикого типа с увеличенной продолжительностью жизни CR увеличивало экспрессию белков, участвующих в биосинтезе жирных кислот и биогенезе митохондрий, и подавляло окислительный стресс. Большинство этих изменений наблюдались преимущественно в жировой ткани, а не в других тканях. Напротив, CR-ассоциированное продление жизни и изменения в жировой ткани не наблюдались у мышей SREBP-1c KO. Сообщается, что белок PGC-1α является ключевым регулятором CR-индуцированного митохондриального биогенеза [ 46 ]. Мы наблюдали, что SREBP-1c связывается с промотором гена Pgc-1α, предполагая, что SREBP-1c непосредственно регулирует транскрипцию Pgc-1α [ 47 ]. Более того, результаты анализа протеома жировой ткани показали, что CR активирует цикл пируват / малат [ 48 ]. Действительно, сообщалось, что CR активирует биосинтез de novo жирных кислот в жировой ткани, но не в печени [ 45 ]. Эти данные показывают, что мыши SREBP-1c KO не могут эффективно использовать жиры в условиях CR. Таким образом, жировая ткань может не только функционировать в качестве ткани для хранения энергии, но также может играть роль превращения глюкозы в более энергоемкую жирную кислоту через SREBP-1c в условиях CR.
Обсуждение CR с точки зрения гипотезы адаптивного ответа
В 1989 году Холлидей объяснил эффекты анти-старения и увеличения срока жизни от СR с эволюционной точки зрения организмов, которые разработали адаптивные системы реагирования, чтобы максимизировать выживаемость в периоды нехватки продовольствия [ 49, 50 ]. На основе этой эволюционной точки зрения мы разделили выгодные действия CR на две системы; «Системы, активированные при достаточных условиях энергоресурсов» и «системы, работающие при недостаточных условиях энергоресурсов». Первая активируется в естественных условиях окружающей среды, которые предоставляют животным свободное использование энергии за счет обеспечения обильного питания. Другими словами, когда есть много пищи для свободного использования энергии, животные хорошо растут, воспроизводят больше и сохраняют избыточную энергию как ТГ в жировой ткани для последующего использования, но не настолько, чтобы они страдали ожирением. Вторая система активируется в естественных условиях окружающей среды, которые не позволяют свободно использовать энергию из-за нехватки продовольствия. Другими словами, когда нет никакой пользы от свободного использования энергии, животные подавляют рост и размножение и используют сэкономленную энергии от роста и размножения для поддержания биологической функции. Адаптация к естественным изменениям окружающей среды является главным приоритетом для выживания животных.
На основе гипотезы адаптивного ответа и недавних выводов, упомянутых выше, мы предлагаем набор механизмов для полезных действий CR.
Поскольку экспериментальные условия CR могут имитировать недостаточные энергетические условия, мы предположили, что CR подавляет «системы, активированные при достаточных энергетических условиях» и активирует «системы, активированные при недостаточных энергетических условиях» и аддитивно индуцирует действия против старения и по увеличению срока жизни. Первый набор систем включает сигналы GH / IGF1, FOXO, mTORC, адипонектин и BMAL1, и CR, по-видимому, подавляет эти анаболические реакции. Второй набор систем включает сигнализацию SREBP-1c / митохондрия, SIRT и NPY, и, вероятно, CR активирует эти реакции для оптимального использования недостаточных энергетических ресурсов. Более того, различные сигналы и / или факторы могут вносить вклад в антивозрастные и продлевающие жизнь действия CR в различной степени с антиоксидантными, противовоспалительными, противоопухолевыми и другими действиями в различных тканях.
В отношении парадигм диетического вмешательства применялись не только CR, но также прерывистое ограничение энергии (IER) и ограничение времени питания (TRF) [ 2 ]. IER обычно включает пост через день или 2-3 дня в неделю. TRF, который более популярен в исследованиях ожирения, чем исследования биогеронологии, как правило, предполагает ограничение доступа к питанию (с высоким содержанием жиров) в течение нескольких часов в день. Благоприятные эффекты, вызванные IER или TRF, частично схожи с вызванными CR. Однако, насколько нам известно, никакие исследования не использовали строгие планы исследований, включая графики питания, чтобы сравнить три диетических вмешательства. Поэтому в будущем могут потребоваться сравнительные исследования CR, IER и TRF.
Перспективы
Исследования с использованием обезьян показывают, что полезные действия CR могут возникать также и у людей, и у других млекопитающих [ 51 ]. Текущие исследования CR фокусируются на двух темах, то есть на выявлении молекулярных механизмов CR, а также на развитии миметических препаратов CR. Мы считаем, что разработка новых препаратов, действующих как CR может быть затруднена без понимания молекулярных механизмов CR. Для разработки таких препаратов, которые применимы к людям, необходимы дальнейшие исследования молекулярных механизмов CR, особенно у приматов. В этом докладе мы предлагаем классифицировать и обсуждать молекулярные механизмы полезных действий ЧК в зависимости от того, работают ли они в условиях богатых или недостаточных энергетических ресурсов. Дальнейшие исследования молекулярных механизмов полезных действий CR должны также учитывать, в какой степени участвующие сигналы / факторы вносят вклад в противоокислительные, противовоспалительные, противоопухолевые и другие действия CR в каждой ткани или органе, и тем самым приводят к омолаживанию и увеличению продолжительности жизни. Исследования генетически модифицированных животных с упором на одну из двух систем, упомянутых выше, показывают различия в степени CR-индуцированных эффектов у мышей различного происхождения и тех, которые сравнивают полезные действия CR с факторами IER или TRF, помогут прояснить не только дальнейшие молекулярные механизмы CR, но также и те, которые связаны с продолжительностью жизни.
Источник:
Hoshino S, Kobayashi M, Higami Y. Mechanisms of the anti-aging and prolongevity effects of caloric restriction: evidence from studies of genetically modified animals. Aging (Albany NY). 2018 Sep 16.
Автор: Batin








