Трудности отцовства морских коньков: генетические метаморфозы иммунной системы

В природе полно загадочных явлений и процессов, которые не всегда удается сразу объяснить, разложив все составляющие по полочкам. Одним из таких процессов является беременность. Конечно, все мы знаем, как этот процесс начинается и что получается в итоге. Однако беременность у человека не то же самое, что беременность у морских коньков. Самое явное отличие это пол беременной особи — у коньков это самцы. И тут возникает ряд вопросов, касающихся иммунной системы самца, которая должна пройти серьезные метаморфозы, чтобы не убить будущее потомство, но при этом защищать самца от чужеродных микроорганизмов. Группа ученых из центра исследований океана им. Гельмгольца (Киль, Германия) изучила иммунную систему 12 видов сингнатин (рыбы-иглы) и морских коньков. Какие изменения происходят в организме будущих отцов во время беременности и как эта информация может помочь людям в борьбе с заболеваниями иммунной системы? Об этом мы узнаем из доклада ученых. Поехали.
Основа исследования
Беременность является самой сильной природной защитой будущего потомства. Защита от температурных перепадов, от аноксии, от осмотического стресса и т.д. Будущая мать или отец становятся настоящим сейфом со встроенной системой жизнеобеспечения, что требует от них внушительных вложений, проявляющихся в виде анатомических и физиологических изменений собственного тела.
С точки зрения иммунологии самым значимым изменением является принятие, а не отторжение, эмбриона, который несет аллели (грубо говоря, гены) не только беременной особи, но и второго родителя. Другими словами, если иммунитет не перестроится, то эмбрион становится чужеродным телом, которое необходимо уничтожить. Но перенастройка иммунитета имеет и обратную сторону — снижение защиты от различных патогенов.
У позвоночных уникальное разнообразие генов главного комплекса гистосовместимости* (ГКГС) I и II классов играет ключевую роль в процессе определения «свой — чужой» (родные клетки и чужеродные).
Главный комплекс гистосовместимости* — часть генома или семейство генов, которые отвечают за развитие иммунитета.
Одной из форм защиты эмбриона от отторжения является трофобласт — внешний слой клеток бластоциста (ранняя стадия развития эмбриона), который формирует начальный внешний слой оболочки эмбриона.
Трофобласты не экспрессируют ГКГС II и, таким образом, предотвращают презентацию антигена в материнские T-хелперные (Th*) клетки, что предотвращает иммунный ответ. Помимо этого происходит подавление экспрессии генов ГКГС I (HLA-A, -B и -D).
Th* (Т-хелперы) — T-лимфоциты, усиливающие адаптивный иммунный ответ (приобретенный иммунитет).
Эти иммунологические адаптации опосредованы перекрестной связью между плацентарными трофобластами и иммунными клетками матки, в частности естественными киллерными клетками и регуляторными Т-клетками (Tregs). Tregs подавляют иммунные реакции Th1 — это подтверждается тем, что дефицит Tregs приводит к выкидышу.
Чтобы лучше понять эволюцию беременности и соответствующих молекулярных взаимодействий в организме, ученые решили изучить одних из самых необычных родителей на планете, а именно представителей отряда Syngnathiformes. Виды в этом отряде демонстрируют широкий спектр беременности у самцов: внешнее прикрепление яиц к животу (в подсемействе Nerophinae); дополнительная внешняя защита посредством кожных мешков (у Doryrhamphus, Oosthethus и Solegnathiinae); внутренняя беременность (у Syngnathus) и т.д. (изображение №1).
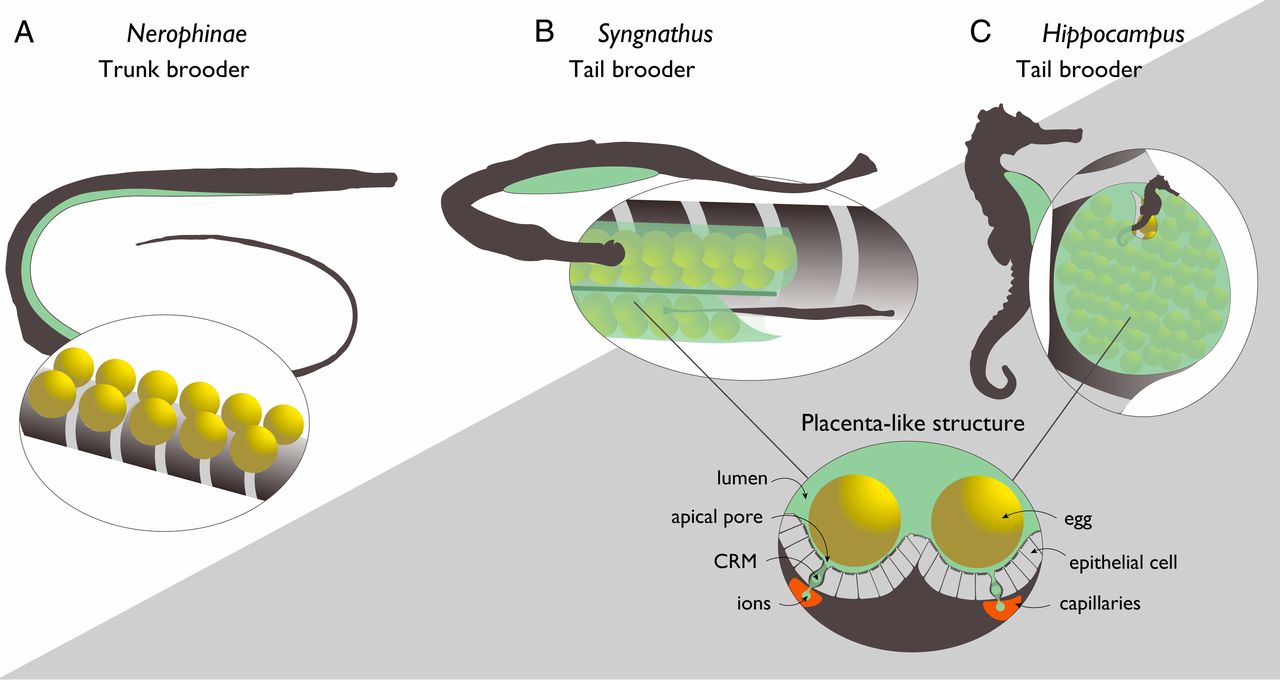
Изображение №1
В последних двух родах оплодотворенные яйца (а затем и вылупившиеся зародыши) покрываются и эффективно интегрируются родительскими тканями и снабжаются питательными веществами, кислородом и родительским иммунитетом через плацентоподобный орган.
Основной теорией, рассматриваемой в данном исследовании, является геномная модификация адаптивной иммунной системы, что и обеспечивает принятие эмбриона, т.е. иммунологическую толерантность.
Результаты исследования
Для исследования были собраны генетические данные 12 видов Syngnathiformes. Филогенетический анализ показал, что отряду Syngnathiformes уже порядка 80 миллионов лет. Виды, входящие в этот отряд, продемонстрировали достаточно вариативный размер генома: от 347 Mbp у Syngnathus rostellatus до 1.8 Gbp у Entelurus aequoreus (1 Mbp = 106 bp; 1 Gbp = 109 bp, где bp — спаренные основания*).
Спаренные основания* — пара двух азотистых оснований нуклеотидов на комплементарных цепочках нуклеиновых кислот.
Любопытно, что виды Syngnathiformes, у которых отсутствует мужская беременность (Fistularia tabacaria, Mullus surmuletus, Dactylopterus volitans, Aeoliscus strigatus и Macroramphorus scolopax) имеют более крупные геномы, чем оба рода с полноценной мужской беременностью (т.е. все виды Hippocampus и Syngnathus). Напротив, у рыб-игл Nerophinae с наружной мужской беременностью (Nerophis ophidion и E. aequoreus) геномы значительно крупнее.
Чтобы сопоставить модификации адаптивного иммунитета со стадией беременности, ученые проанализировали набор ключевых генов из собранных геномов.
ГКГС I и ГКГС II крайне важны для процесса распознавания несобственных пептидов, представляя их CD8+ и CD4+ T-клеткам соответственно. Если теория исследователей верна, то все виды с мужской беременностью претерпели значительные модификации своей адаптивной иммунной системы, характеризующиеся потерями или изменениями ключевых генов ГКГС II (изображение №2).
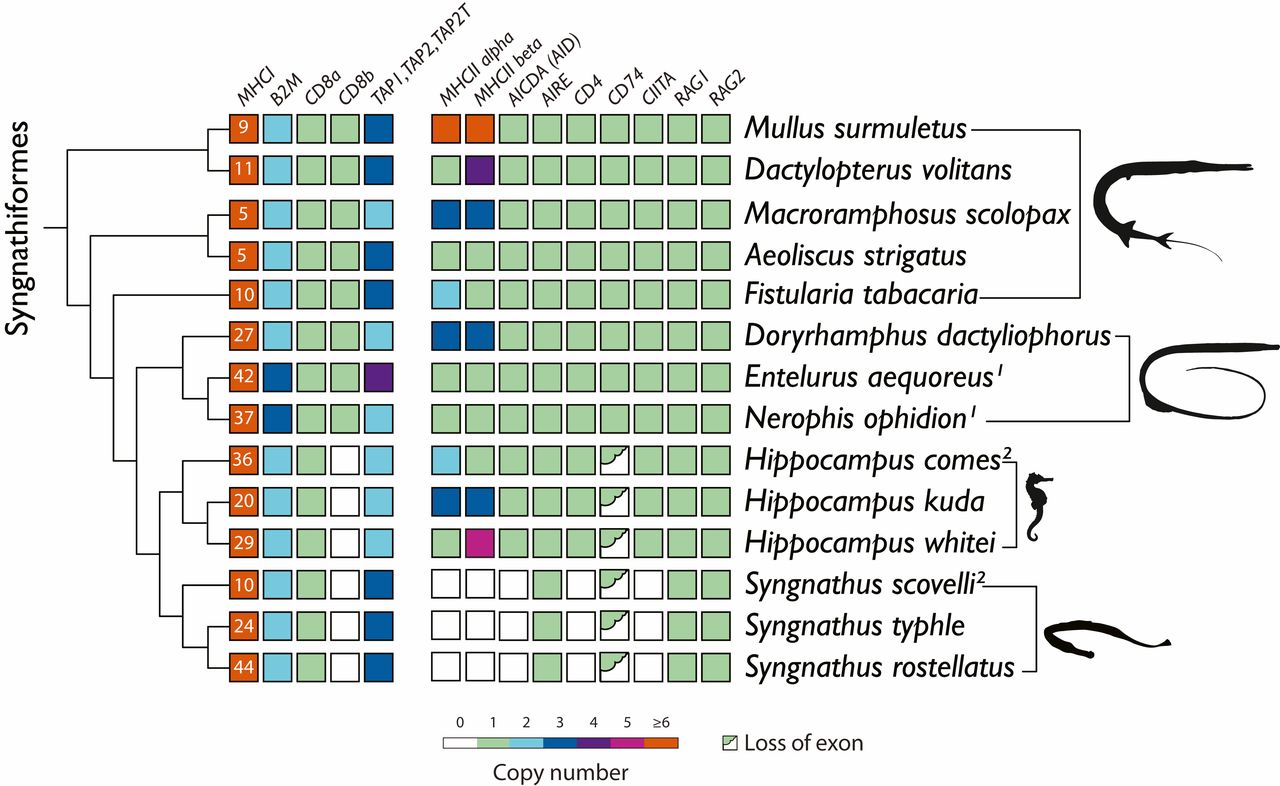
Изображение №2
Инвариантная цепь ГКГС II (CD74*), предотвращающая преждевременное пептидное связывание MHC II, демонстрирует дивергентный экзон* 3 у Syngnathus и Hippocampus по сравнению как с млекопитающими, так и с другими костистыми рыбами (изображение №3).
CD74* (инвариантная цепь) — мембранный белок, участвующий в работе иммунной системы.
Экзон* — участок ДНК, копия которого составляет зрелую РНК.
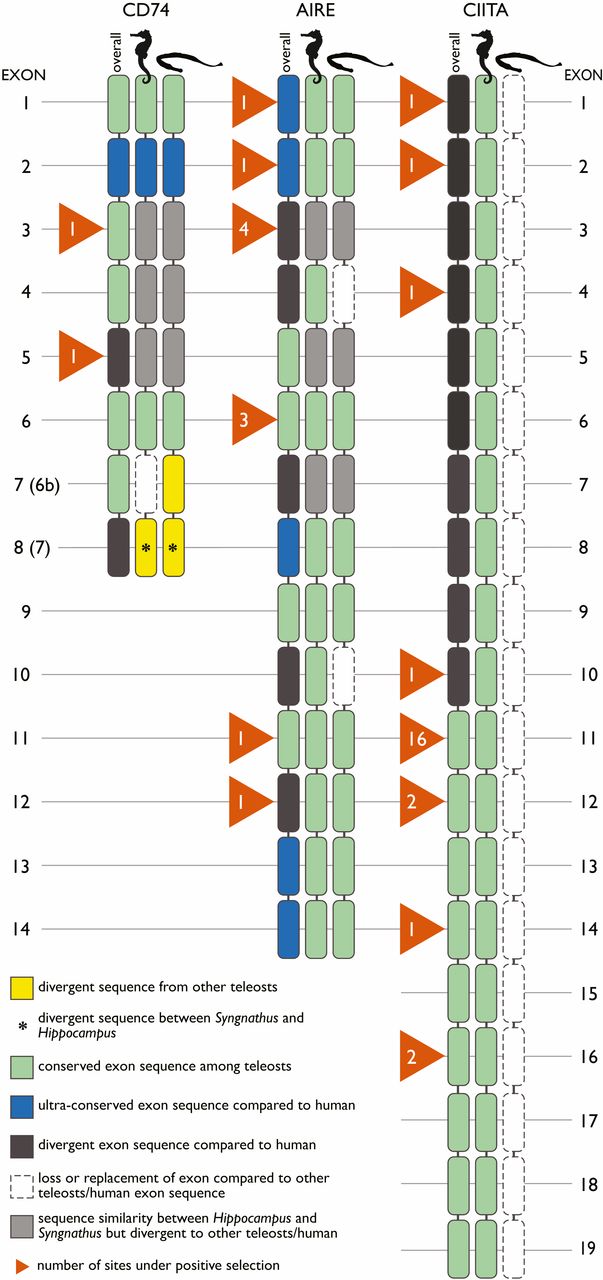
Изображение №3
Кроме того, у вида Hippocampus была обнаружена последовательность замены экзона 6b, в то время как Syngnathus показал дивергентный экзон по сравнению с другими рыбами и людьми. Оба экзона (3 и 6b) расположены в области белка, выступающей в эндосомальный* просвет.
Эндосома* — мембранная внутриклеточная органелла, формируемая за счет слияния и созревания эндоцитозных пузырьков.
Ученые считают, что именно эти процессы и нарушают функции CD74.Самым же значимым изменением в геноме Syngnathus является потеря гена, кодирующего классические α- и β-цепи ГКГС II. Результатом этого является отключение представления антигенов рецептору T-клеток на CD4+ T-лимфоцитах. Это подтверждается потерей CD4, обеспечивающей успешное связывание рецепторов и активацию CD4+ T-лимфоцитов (AICDA). Единственным каноническим геном ГКГС II, оставшимся в геномах Syngnathus, был аутоиммунный регулятор, управляющий центральной толерантностью, когда устраняются любые развивающиеся Т или В клетки, реагирующие на самих себя.
Совокупность полученных данных прямо говорит о том, что Syngnathus утратили ГКГС II.
С Hippocampus ситуация оказалась намного сложнее. Подобные модификации, как у Syngnathus для гена CD74, наблюдались в отношении дивергентного экзона 3 и замены экзона 6b. Важно отметить, что не наблюдалось потери генов ГКГС II, как у всех трех видов Syngnathus.
Однако у Hippocampus последовательности генов ГКГС II, в частности β-копии, сильно отличались от других функциональных генов ГКГС II, обнаруженных у видов с функционирующими ГКГС II (сибас, лосось и т.д.). Более того, в третичной структуре* β-генов ГКГС II Hippocampus отсутствуют два критически важных цистеиновых мостика*, которые необходимы для формирования пептидсвязывающего кармана молекулы MHC II.
Третичная структура* — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи.
Цистиновые мостики* участвуют в формировании и поддержании третичной структуры белков и пептидов.
Более тщательное изучение инвариантной цепи, кодирующей ген CD74, также позволяет предположить, что эволюция адаптивного иммунитета прошла разными путями у двух родственных родов Syngnathus и Hippocampus.
В то время как у Syngnathus основные гены пути ГКГС II были потеряны, у Hippocampus они сохранились и показывают четкое расхождение последовательностей по сравнению с другими костными рыбами и людьми. У исследователей есть несколько возможных объяснений ситуации с ГКГС II у Hippocampus.
Первое — расхождение последовательностей основных генов ГКГС II в отличие от других рыб плюс признаки положительного отбора могут указывать на то, что у Hippocampus гены ГКГС II приобретают дополнительные или совсем новые функции.
CD74 имеет ключевое значение для функционирования ГКГС II. Хотя обычно CLIP-белок CD74 (экзон 3) ассоциируется с ГКГС II, остальные экзоны CD74 действуют как трансферы, транспортируя ГКГС II в загрузочный отсек. Потеря экзона 6b в гиппокампе может указывать на скомпрометированный процесс загрузки. Следовательно, система ГКГС II у Hippocampus, вероятно, будет менее эффективной в отличие от других позвоночных, что может быть достаточно для развития полноценной беременности у самцов.
Второе — ГКГС II, возможно, не нарушен с точки зрения его функций, несмотря на потерянные и дивергентные экзоны CD74 из-за функциональной перестройки иммунной системы. Однако такой вариант очень маловероятен, поскольку тесты на мышах с трансгенной экспрессией укороченного белка CD74, у которого отсутствует область CLIP (у Hippocampus она отличается от остальных костных рыб), показали, что CD74 не может выполнять транспортировку ГКГС II.
Что касается ГКГС I, то недавнее изучение Gadiformes (трескообразные) показало независимую потерю ГКГС II, от чего была предложена теория — диверсификация генов ГКГС I компенсирует потерю функционального ГКГС II.
Для проверки применимости этой теории к Syngnathidae (игловые) была проведена оценка числа генов ГКГС I с использованием наиболее консервативного экзона 4. Данная оценка показала, что число этих генов у всех видов с полноценной беременностью у самцов выше по сравнению с видами без нее: Nerophinae с наружной беременностью у самцов — 27–42 копии; Hippocampus и Syngnathus с полной беременностью — 20-36 и 24-44 копии; виды без беременности самцов — 5-10 копий.
В то время как все идентифицированные последовательности ГКГС I у Syngnathiformes являются частью линии U, отдельный кластер последовательностей ГКГС I у Syngnathid поддерживает потенциальную коэволюцию ГКГС I и мужской беременности.
Помимо этого, ключевые гены ГКГС I, такие как β2-микроглобулин и CD8, относились к положительному отбору (когда новые выгодные для вида генетические изменения начинают развиваться) у игловых. Следовательно, часть функций переходит от ГКГС II к ГКГС I, ввиду полной потерей или изменением ГКГС II.
Также стоит отметить, что любая беременность сопряжена с определенными физиологическими изменениями. В случае с игловыми наблюдается изменение генов гемоглобина, что способствует лучшему переносу кислорода при беременности у самцов. Во-первых, все игловые утратили ген гемоглобина альфа 6. Во-вторых, виды с полной беременностью у самцов (Syngnathus и Hippocampus) дополнительно утратили и альфа 5. Однако эта потеря была компенсирована приобретенным геном альфа 1 и альфа 2.
Следующий этап исследования заключался в поиске ответа на вопрос — нужна ли для эволюции иммунологической толерантности некая совместимость генов и физиологических процессов при женской и мужской беременности. Для этого был проведен анализ паттернов экспрессии генов в тканях выводкового мешка S. typhle.
В анализе брали участие две группы самцов: с неразвитым и с полностью развитым выводковым мешком. Все дифференциально экспрессируемые гены подвергались поиску потенциальных функций с помощью гомологии, т.е. путем сравнения описанных функций при беременности у млекопитающих женского пола (ящерица вида Chalcides ocellatus или глазчатый халцид) и при мужской беременности (S. scovelli и Hippocampus abdominalis).
Суммарно было обнаружено 141 ген, который так или иначе отличался во время мужской беременности у S. typhle и S. scovelli. Направление экспрессии в дифференциально экспрессируемых генах коррелировало между S. typhle и S. scovelli, подразумевая, что повышение или понижение регуляции во время беременности было в основном одинаковым у обоих видов игловых. В частности, это проявлялось у четырех генов с наиболее явным повышением регуляции во время беременности (MYOC, HCEA, LS-12, APOA1) и для двух генов, которые продемонстрировали понижение регуляции во время беременности (STX2 и MSXC).
Было обнаружено, что 116 генов, участвующих в важных процессах во время беременности у человека, были дифференциально выражены во время мужской беременности у S. typhle. Эти гены участвовали в деградации желтого тела, транспорте веществ родитель-эмбрион, развитии плаценты, росте эмбриона и т.д. (изображение №4).
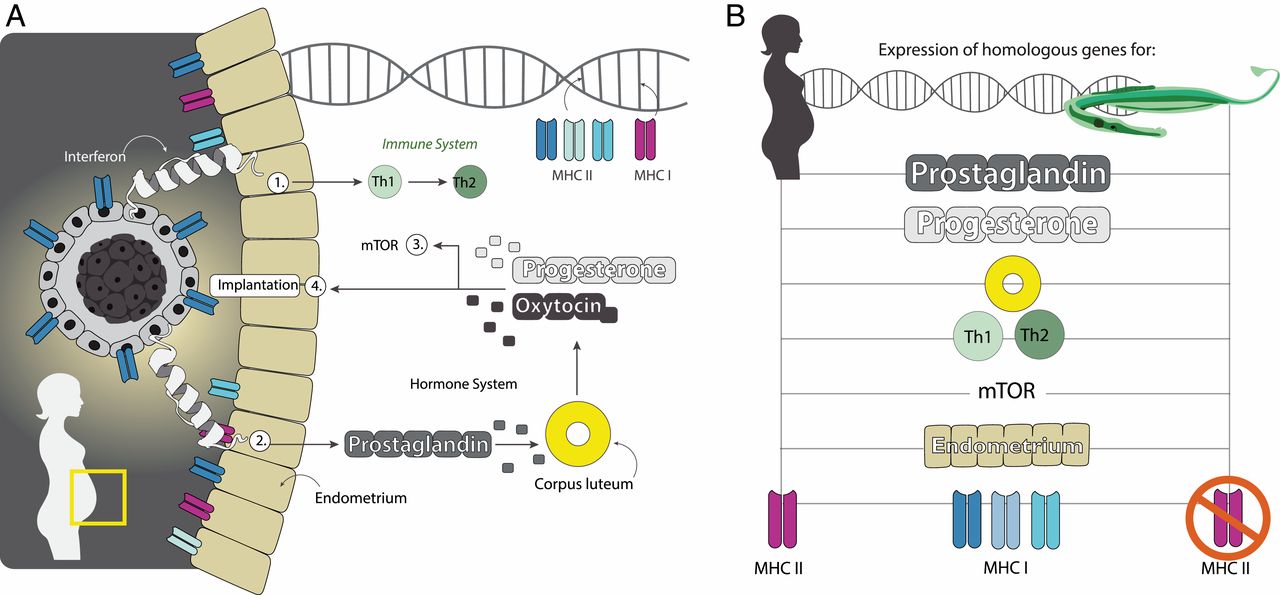
Изображение №4
Другими словами, нельзя сказать, что самцы во время беременности преобразуются в самок на генетическом уровне. Однако их генетический набор претерпевает определенные изменения, т.е. имеет место смешанный набор генов и схожие физиологические пути взаимодействия молекул.
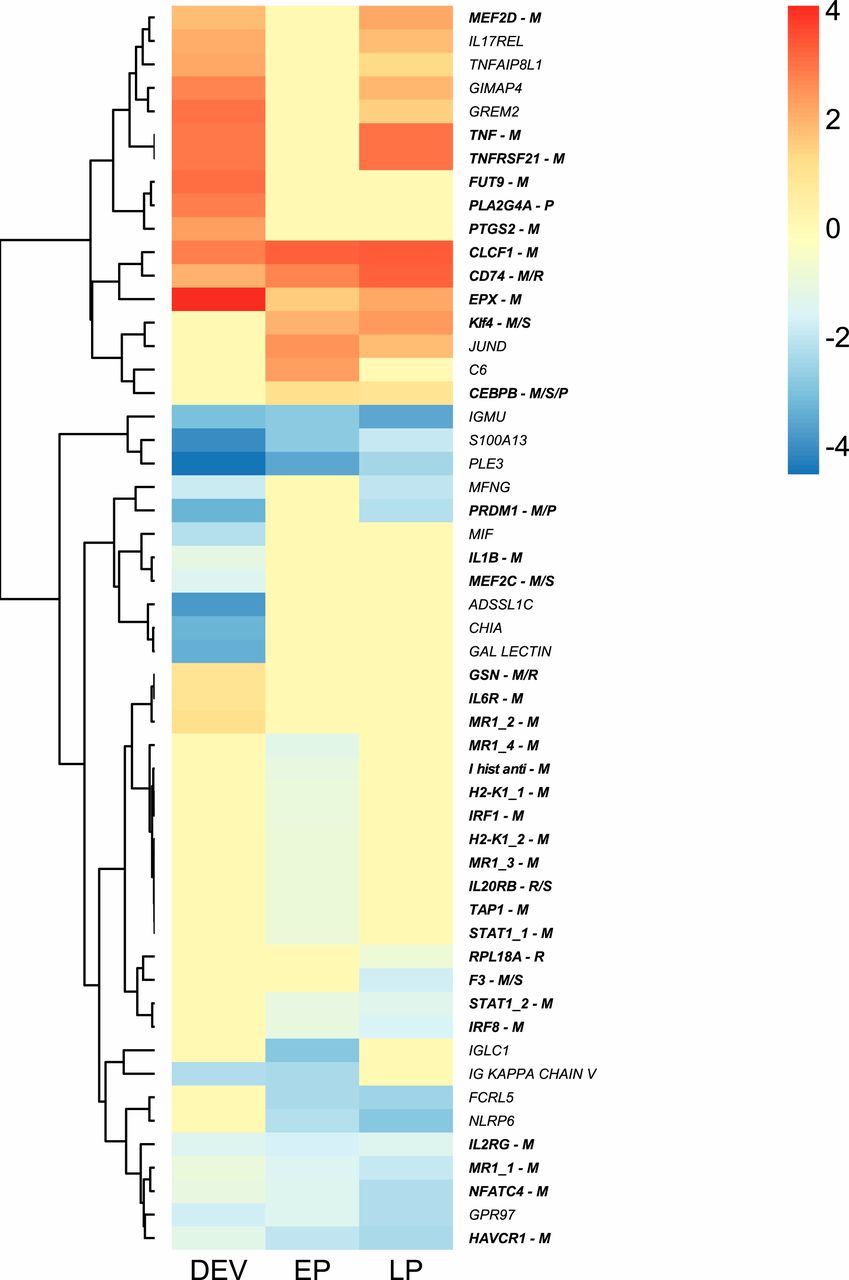
Изображение №5
Заключительным этапом исследования стало изучение изменений экспрессии иммунных генов, которые сопровождают модификацию ГКГС II и расширение репертуара гена ГКГС I.
В совокупности наблюдаемые изменения экспрессии генов во время мужской беременности способствуют иммунологической толерантности во время беременности, что очевидно из репертуара генов.
В частности, были выявлены изменения экспрессии провоспалительных Th1 и противовоспалительных ответов Th2 и одновременное подавление ГКГС I во время беременности самцов, которые напоминают изменения экспрессии во время беременности млекопитающих. Также имело место подавление образования и пролиферации лимфоцитов за счет подавления белков CHIA и MEF2C, активизации GIMAP4 (усиливает апоптоз лимфоцитов) и за счет усиления регуляции репрессора транскрипции PRDM1 (способствующую росту плаценты и морфогенезу).
В соответствии с переходом от Th1 к Th2 иммунным ответам во время беременности у млекопитающих, белок CEBPB, который репрессирует Th1, но облегчает иммунный ответ Th2, был повышен во время беременности самцов у игловых.
На поздних сроках беременности гены GPR97 и MFNG (оба ответственны за дифференцировку В-клеток) подвергались понижающей регуляции наряду с генами NFATC4 и HAVCR1, которые участвуют в созревании Т-клеток.
По аналогии с беременностью у человека, CASP3 модифицирует ГКГС I для поддержания иммунологической толерантности, потому у самцов игловых CASP3 был повышен во время беременности.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых [1] и дополнительные материалы [2] к нему.
Эпилог
В данном исследовании ученые показали, что морские коньки и другие виды с мужской беременностью подверглись колоссальным изменениям их иммунной системы, утратив один из важнейших ее элементов — ГКГС II. В дополнение к этой утрате наблюдается снижение активности второго элемента — ГКГС I, что наблюдается во время беременности у самок млекопитающих.
Как говорят сами ученые, подобное изменение может казаться незначительным, однако столь радикальные генетические метаморфозы сравнимы с открытием нового вида.
Изучение беременности у самцов морских коньков не только помогает лучше понять этих существ, но способствует расширению наших знаний в области иммунологии. К примеру, гены, потерянные в ходе эволюции игловых, кодируют молекулярные пути, которые подвергаются атаке вируса иммунодефицита человека.
Ученые заявляют, что игловые, способные выживать без столь важных составляющих иммунитета, могут стать отличной исследовательской моделью. Ведь понимание генетических изменений, связанных с формированием иммунной толерантности во время беременности игловых, может помочь в понимании механизмов развития иммунных заболеваний у человека.
Морские коньки отличаются не только необычной беременностью, но и любовью к танцам.
Юмористическое, но вполне правдивое описание морских коньков.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Немного рекламы :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99 [3], уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? [4] (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 [5] в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки? [6]
Автор: Dmytro_Kikot
Источник [7]
Сайт-источник PVSM.RU: https://www.pvsm.ru
Путь до страницы источника: https://www.pvsm.ru/biotehnologii/352242
Ссылки в тексте:
[1] доклад ученых: https://www.pnas.org/content/pnas/early/2020/04/08/1916251117.full.pdf
[2] дополнительные материалы: https://www.pnas.org/content/pnas/suppl/2020/04/09/1916251117.DCSupplemental/pnas.1916251117.sapp.pdf
[3] облачные VPS для разработчиков от $4.99: https://ua-hosting.company/cloudvps/nl
[4] Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер?: https://habr.com/company/ua-hosting/blog/347386/
[5] 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199: https://ua-hosting.company/serversnl
[6] Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?: https://habr.com/company/ua-hosting/blog/329618/
[7] Источник: https://habr.com/ru/post/497490/?utm_source=habrahabr&utm_medium=rss&utm_campaign=497490
Нажмите здесь для печати.