 Иследователи Стэнфордского университета нашли катализатор для производства больших объёмов чистого водорода путём электролиза воды, процесса пропускания электрического тока через раствор.
Иследователи Стэнфордского университета нашли катализатор для производства больших объёмов чистого водорода путём электролиза воды, процесса пропускания электрического тока через раствор.
Сегодня водород H2 чаще всего получают из метана CH4 и других углеводородов. Каждый год производят десятки миллионов тонн этого самого распространённого во Вселенной газа, он находит применение в химической промышленности.
Профессор химической инженерии Томас Харамильо и его научный сотрудник Якоб Кибсгаард хотят использовать процесс электролиза для выделения водорода из воды и использования полученного продукта для хранения солнечной энергии, но для повсеместного распространения подобного подхода им нужно значительно удешевить процесс.
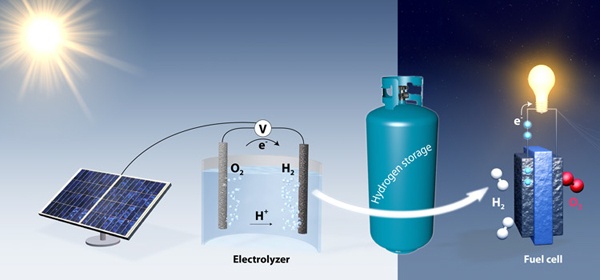
Процесс электролиза воды выглядит следующим образом: два электрода опускаются в воду, затем по ним пропускают электроток, и на их поверхности выступают пузырьки составляющих воду элементов. Но для этого процесса необходим катализатор на электродах, и традиционно это платина, довольно дорогое решение.
Именно замена этого редкого металла на что-либо более доступное нужна для удешевления процесса электролиза. В немецком научном журнале Angewandte Chemie Харамилло и Кибсгаард описали чистый, надёжный и эффективный заменитель драгоценному металлу. И их намерения выходят далеко за пределы текущего рынка химической промышленности.
Сейчас использование солнечных батарей во многом упирается в хранение и преобразование энергии, распространённые и дешёвые системы которых найти довольно трудно. Исследователи из Стэнфорда считают, что им под силу превратить баки с водой в аккумуляторы.
Днём солнечные батареи будут вырабатывать электроэнергию, а её излишки будут использоваться для выработки водорода и кислорода. Ночью эти газы снова соединяются в воду в топливных ячейках, вырабатывая электроэнергию для потребителей электрической сети. В отличие от аккумуляторов, которые включают в свой состав электролит, потенциально несущий вред для экологии при его неправильной утилизации, такое хранение — чистое и безопасное.
На наноуровне платина в процессе электролиза закрепляет голый протон потерявшего свой электрон атома водорода до той поры, пока атом водорода не сможет подобрать электрон для формирования молекулы H2 в паре с другим таким же атомом водорода.
И загвоздка состоит в том, чтобы найти катализатор с определённой силой связи: если она слишком слаба, то атом водорода не удержится, если она будет слишком сильной, то он так и не будет отпущен.
Платина для этих целей подходит идеально, но в прошлом году в Стэнфорде было обнаружено, что её аналогом может быть вариант сульфида молибдена, катализатора, широко используемого в переработке нефти для крэкинга тяжёлых углеводородов. Оказалось, что некоторые из его свойств подходят хорошо.
Кроме этого катализатора исследователи также позаимствовали у индустрии нефтеперегонки и другой трюк. По экологическим причинам во время обработки из нефти часто удаляют серу для снижения частоты кислотных дождей. Часть атомов серы задерживается на поверхности катализатора и увеличивает его активность.
Уже известный своим положительным влиянием на реакцию электролиза воды фосфид молибдена была соединён с серой. В результате был получен новый катализатор фосфосульфид молибдена, который оказался ещё более эффективным в реакции выделения водорода, чем оригинальное вещество.
Новый катализатор по эффективности и долговечности приближается к платине, что очень важно в промышленных установках, где электроды должны работать продолжительное время. Сейчас идут работы над его улучшением на наноуровне.
По материалам Stanford News.
Автор: FakeFactFelis






