Когда сенолитики вызывают гибель сенесцентных клеток, иные (более юные) клетки обязаны реплицироваться и занимать место убитых клеток. Эта репликация клеток вызывает укорочение теломер, что может привести к образованию новых сенесцентных клеток. Как получается, что процесс уничтожения сенесцентных клеток не является саморазрушающим, если создаются новые сенесцентные клетки?
Есть несколько способов ответить на этот вопрос. Во-первых, просто взгляните на восхитительные эффекты сенолитических препаратов или генной терапии у старых мышей и мышиных моделей возрастных заболеваний. В этих экспериментах сенолитические препараты восстановили физическую активность и способность формировать новые прогениторные кровяные и иммунные клетки на уровне юных мышей, при этом предотвращая возрастную гипофункцию лёгких, жировые инфильтрации в печень, ослабление или остановку сердца, остеопороз и облысение. Также они предотвратили или вылечили мышиные модели заболеваний старения, таких как остеоартрит, фиброзных заболеваний лёгких, неалкогольной жировой болезни печени (НАЖБП), атеросклероза, рака и побочных эффектов обычной химиотерапии, а также нейродегенеративные заболевания, такие как болезни Паркинсона и Альцгеймера и многие иные! Таким образом, какой бы побочный ущерб ни происходил при убийстве сенесцентных клеток, совершенно ясно, что сенолитическое лечение приносит намного больше пользы.
Но давайте лучше рассмотрим основную причину вопроса. Предположим (в соответствии с вопросом), что каждый раз, когда вы уничтожаете сенесцентную клетку, прогениторная клетка (одна из частично специализированных тканеспецифических клеток, которые заселяют ткань зрелыми клетками, специфичными этой ткани), реплицируется, чтобы создать новую клетку. И эксперименты показывают, что когда сенесцентные клетки погибают в ткани, прогениторные клетки начинают размножаться и / или функционировать лучше. Но причины не в том, что прогениторные клетки автоматически реплицируются и замещают сенесцентную клетку, а в том, что воспалительные факторы, выбрасываемые из сенесцентных клеток, подавляют их регенеративную функцию, так что уничтожение сенесцентных клеток позволяет им начать снова работает нормально. Это наблюдается в клетках костного , в прогениторных клетках сердечной мышцы, в клетках, образующих кости, и в клетках, образующих новые жировые клетки – как у мышей, так и (в небольшом клиническом испытании) у человека!
Ну и правы ли вопрошающие? На самом деле, нет. Требуется всего лишь минутная мысль, чтобы понять, что одной такой репликации может быть мало, чтобы привести стволовую / прогениторную клетку к сенесцентности: если бы это было так, конечно, сенолитическая терапия не смогла бы уменьшить общее число сенесцентных клеток. Но эксперименты ясно показывают, что использование сенолитиков снижает общее число сенесцентных клеток в тканях.
Кроме того, если бы эти препараты не убивали больше сенесцентных клеток, чем они генерировали косвенно, вы бы не получили указанные феноменальные эффекты – и, конечно, вы их получили во многих тканей и многих моделях старения и возрастных заболеваний.
Возвращаясь к вопросу
Тем не менее, даже если одного курса сенолитиков мало, чтобы вызвать старение стволовых клеток, что, если вы запускаете старение стволовых клеток в тканях каждые два курса – или каждые три, или четыре, или десять? Может ли один курс сенолитических препаратов принести чистую пользу, в то время как циклическое лечение в течение всей жизни будет постепенно истощать пулы стволовых клеткок ткани, и в конечном итоге насыщая организм сенесцентными клетками и оставляя пациента (мышь или человека) хуже в перспективе?
К счастью, у нас есть исследования этого вопроса – и они снова говорят нам, что ответ «нет».
В эксперименте, который сыграл решающую роль в запуске революции в сенолитических терапиях, мыши были спроектированы с генетическим механизмом апоптоза, встроенным во все их клетки, который не функционировал, пока не активировался инструкцией из двух частей: экспрессией гена p16, которая характерна для сенесцентных клеток; и активирующим лекарством, которое учёные могли применять в целях контроля темпа сенолитической активности. Затем учёные подождали, пока животным не исполнится 12 месяцев (по человеческим меркам это похоже на человека в возрасте 40 лет), прежде чем вводить препарат впервые. Затем они продолжили вводить лекарство каждые две недели в течение следующих шести месяцев, и всего животные получили 13 циклов сенолитической терапии и были примерно похожи на людей в возрасте 50 лет.
Эксперименты явно показали, что животные получили пользу от сенолитической терапии даже после многих непрерывных циклов в течение их естественного среднего и по ранний пожилой возраст. Например, животные, чей механизм саморазрушения сенесцентных клеток был запущен, лучше сохранили функцию почек, и меньшее количество из них умерло в среднем и в раннем пожилом возрасте.
Учёные изучали влияние нескольких курсов сенолитической терапии на общее число сенесцентных клеток, а также существенно ли они истощали запасы функциональных прогениторных клеток у животных. Для этого учёные изучили влияние терапии на преадипоциты (клетки, образующие жировые клетки (адипоциты)) в жировой ткани животных – удобное место поиска, поскольку её легко найти, и она накапливает немалое число сенесцентных клеток.
После примерно 13 циклов сенолитической терапии у животных была лишь 1/8 числа сенесцентных преадипоцитов по сравнению с контролем (рис. 1 (а)) – очень существенное явное снижение. Но и в этом случае у животных оставалось функциональных прогениторных клеток как в контроле. (Рис. 1 (b)).
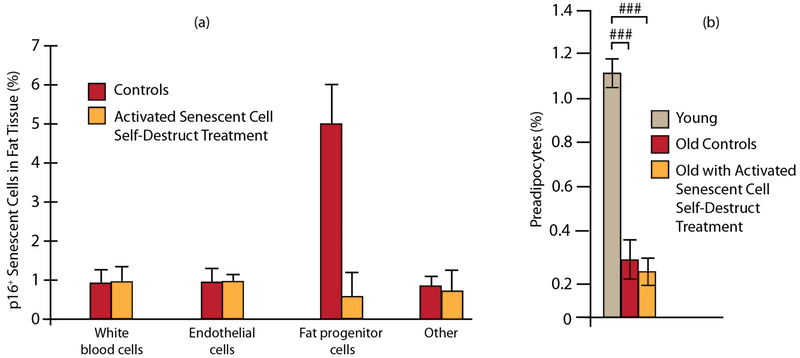
Активация сенолитических генов «самоуничтожения» в течение всей жизни сокращает число сенесцентных клеток (а), практически не влияя на число прогениторных (б) в жировой ткани. Столбцы в (b) с # являются статистически значимыми различиями.
В иной работе учёные инъецировали физетин – растительное сенолитическое вещество – мышам каждые сутки, начиная с момента, когда они уже находились в раннем пожилом возрасте (и, таким образом, уже имели как большое число сенесцентных клеток, так и истощающееся количество прогениторных клеток) и продолжали до их смерти. Указанное лечение сократило количество сенесцентных клеток в большинстве тканей примерно на 50%. Кроме этого, животные жили значительно дольше, а в их тканях были менее выражены возрастные изменения, чем у контрольных животные.
Убираем старое – и вживляем новое
И всё же, важно иметь много функциональных клеток, чтобы воспользоваться всеми преимуществами сенолитической терапии. Это было проиллюстрировано в эксперименте с использованием сенолитических лекарств или генов «самоуничтожения» в лечении животных моделей остеоартрита. Когда заболевание суставов было инициировано травмой у молодых животных, оно привело к хроническому повреждению суставов и накоплению сенесцентных клеток в синовиуме (мембрана, окружающая сустав, в которой живут клетки, вырабатывающие специальную жидкость, которая смазывает сустав). Уничтожение сенесцентных клеток уменьшило воспаление в суставе, предотвратило его разрушение и облегчило боли у животных.
Но сенолитическое лечение было намного менее эффективным, когда учёные повторили эксперимент на старых животных, и причины пролили некоторый свет на наш первоначальный вопрос. По сравнению с юными животными, старые животные накапливали гораздо больше сенесцентных клеток после того, как их суставы были повреждены, и эти клетки располагались в более глубоких слоях ткани, что сопровождалось более тяжёлым остеоартритом. Возможно, это связано с тем, что у старых животных больше клеток уже получили немалый ущерб от старения и намного легче превращались в сенесцентные. И когда старым животным ввели сенолитическое лечение, оставшиеся здоровые клетки также не реагировали: бремя клеток зомби уменьшилось, и старые животные всё ещё получили некоторое облегчение боли, но гены, которые помогли юным животным восстановить их повреждённые суставы не были активированы, и их хрящи не улучшились. Учёные полагают, что это может быть связано со снижением числа или функции прогениторных хрящообразующих клеток, вызванных процессами старения.
Точно так же, уничтожение сенесцентных клеток у старых мышей уменьшило излишнее число остеокластов (клеток, разрушающих кость), накапливающихся в стареющей кости, но не восстановило уменьшающийся запас костеобразующих остеобластов, малое число которых, несомненно, ограничило омолаживающие эффекты лечения.
В обоих случаях отсутствие увеличения числа или активности юных клеток не было результатом повреждения сенолитического лечения: уменьшение их числа уже произошло раньше начала лечения. Таким образом, проблема не в том, что сенолитическая терапия перестаёт работать или становится разрушающей со временем: а скорее в её нацеленности лишь на один тип повреждения, в то время как старение вызывает болезни из-за накопления многих типов клеточных и молекулярных повреждений в наших тканях. Решение состоит в том, чтобы соединить уничтожение стареющих клеток с инъекциями свежих новых функциональных клеток при помощи клеточной терапии. (Наш анализ прошлой работы по сенолитической терапии в моделях болезни Паркинсона в целях клинического применения в комбинированной терапии).
И если вернуться к начальному вопросу, это также окажется решением, если внезапно выяснится, что многие циклы сенолитической терапии приведут к старению слишком большого числа стволовых клеток. Но, как мы видели, все данные свидетельствуют – что это не будет проблемой в течение нашей нынешней жизни.
- Zhu Y, Tchkonia T, Pirtskhalava T, Gower AC, Ding H, Giorgadze N, Palmer AK, Ikeno Y, Hubbard GB, Lenburg M, O’Hara SP, LaRusso NF, Miller JD, Roos CM, Verzosa GC, LeBrasseur NK, Wren JD, Farr JN, Khosla S, Stout MB, McGowan SJ, Fuhrmann-Stroissnigg H, Gurkar AU, Zhao J, Colangelo D, Dorronsoro A, Ling YY, Barghouthy AS, Navarro DC, Sano T, Robbins PD, Niedernhofer LJ, Kirkland JL. The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015 Aug;14(4):644-58. doi: 10.1111/acel.12344. Epub 2015 Apr 22. PubMed PMID: 25754370; PubMed Central PMCID: PMC4531078.
- Baar MP, Brandt RMC, Putavet DA, Klein JDD, Derks KWJ, Bourgeois BRM, Stryeck S, Rijksen Y, van Willigenburg H, Feijtel DA, van der Pluijm I, Essers J, van Cappellen WA, van IJcken WF, Houtsmuller AB, Pothof J, de Bruin RWF, Madl T, Hoeijmakers JHJ, Campisi J, de Keizer PLJ. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 2017 Mar 23;169(1):132-147.e16. doi: 10.1016/j.cell.2017.02.031. PubMed PMID: 28340339; PubMed Central PMCID: PMC5556182.
- Chang J, Wang Y, Shao L, Laberge RM, Demaria M, Campisi J, Janakiraman K, Sharpless NE, Ding S, Feng W, Luo Y, Wang X, Aykin-Burns N, Krager K, Ponnappan U, Hauer-Jensen M, Meng A, Zhou D. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nat Med. 2016 Jan;22(1):78-83. doi: 10.1038/nm.4010. Epub 2015 Dec 14. PubMed PMID: 26657143; PubMed Central PMCID: PMC4762215.
- Hashimoto M, Asai A, Kawagishi H, Mikawa R, Iwashita Y, Kanayama K, Sugimoto K, Sato T, Maruyama M, Sugimoto M. Elimination of p19(ARF)-expressing cells enhances pulmonary function in mice. JCI Insight. 2016 Aug 4;1(12):e87732. doi: 10.1172/jci.insight.87732. PubMed PMID: 27699227; PubMed Central PMCID: PMC5033852.
- Ogrodnik M, Miwa S, Tchkonia T, Tiniakos D, Wilson CL, Lahat A, Day CP, Burt A, Palmer A, Anstee QM, Grellscheid SN, Hoeijmakers JHJ, Barnhoorn S, Mann DA, Bird TG, Vermeij WP, Kirkland JL, Passos JF, von Zglinicki T, Jurk D. Cellular senescence drives age-dependent hepatic steatosis. Nat Commun. 2017 Jun 13;8:15691. doi: 10.1038/ncomms15691. PubMed PMID: 28608850; PubMed Central PMCID: PMC5474745.
- Lewis-McDougall FC, Ruchaya PJ, Domenjo-Vila E, Shin Teoh T, Prata L, Cottle BJ, Clark JE, Punjabi PP, Awad W, Torella D, Tchkonia T, Kirkland JL, Ellison-Hughes GM. Aged-senescent cells contribute to impaired heart regeneration. Aging Cell. 2019 Jun;18(3):e12931. doi: 10.1111/acel.12931. Epub 2019 Mar 10. PubMed PMID: 30854802; PubMed Central PMCID: PMC6516154.
- Anderson R, Lagnado A, Maggiorani D, Walaszczyk A, Dookun E, Chapman J, Birch J, Salmonowicz H, Ogrodnik M, Jurk D, Proctor C, Correia-Melo C, Victorelli S, Fielder E, Berlinguer-Palmini R, Owens A, Greaves LC, Kolsky KL, Parini A, Douin-Echinard V, LeBrasseur NK, Arthur HM, Tual-Chalot S, Schafer MJ, Roos CM, Miller JD, Robertson N, Mann J, Adams PD, Tchkonia T, Kirkland JL, Mialet-Perez J, Richardson GD, Passos JF. Length-independent telomere damage drives post-mitotic cardiomyocyte senescence. EMBO J. 2019 Mar 1;38(5). pii: e100492. doi: 10.15252/embj.2018100492. Epub 2019 Feb 8. PubMed PMID: 30737259; PubMed Central PMCID: PMC6396144.
- Farr JN, Xu M, Weivoda MM, Monroe DG, Fraser DG, Onken JL, Negley BA, Sfeir JG, Ogrodnik MB, Hachfeld CM, LeBrasseur NK, Drake MT, Pignolo RJ, Pirtskhalava T, Tchkonia T, Oursler MJ, Kirkland JL, Khosla S. Targeting cellular senescence prevents age-related bone loss in mice. Nat Med. 2017 Sep;23(9):1072-1079. doi: 10.1038/nm.4385. Epub 2017 Aug 21. Erratum in: Nat Med. 2017 Nov 7;23 (11):1384. PubMed PMID: 28825716; PubMed Central PMCID: PMC5657592.
- Yosef R, Pilpel N, Tokarsky-Amiel R, Biran A, Ovadya Y, Cohen S, Vadai E, Dassa L, Shahar E, Condiotti R, Ben-Porath I, Krizhanovsky V. Directed elimination of senescent cells by inhibition of BCL-W and BCL-XL. Nat Commun. 2016 Apr 6;7:11190. doi: 10.1038/ncomms11190. PubMed PMID: 27048913; PubMed Central PMCID: PMC4823827.
- Jeon OH, Kim C, Laberge RM, Demaria M, Rathod S, Vasserot AP, Chung JW, Kim DH, Poon Y, David N, Baker DJ, van Deursen JM, Campisi J, Elisseeff JH. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nat Med. 2017 Jun;23(6):775-781. doi: 10.1038/nm.4324. Epub 2017 Apr 24. PubMed PMID: 28436958; PubMed Central PMCID: PMC5785239.
- Schafer MJ, White TA, Iijima K, Haak AJ, Ligresti G, Atkinson EJ, Oberg AL, Birch J, Salmonowicz H, Zhu Y, Mazula DL, Brooks RW, Fuhrmann-Stroissnigg H, Pirtskhalava T, Prakash YS, Tchkonia T, Robbins PD, Aubry MC, Passos JF, Kirkland JL, Tschumperlin DJ, Kita H, LeBrasseur NK. Cellular senescence mediates fibrotic pulmonary disease. Nat Commun. 2017 Feb 23;8:14532. doi: 10.1038/ncomms14532. PubMed PMID: 28230051; PubMed Central PMCID: PMC5331226.
- Pan J, Li D, Xu Y, Zhang J, Wang Y, Chen M, Lin S, Huang L, Chung EJ, Citrin DE, Wang Y, Hauer-Jensen M, Zhou D, Meng A. Inhibition of Bcl-2/xl With ABT-263 Selectively Kills Senescent Type II Pneumocytes and Reverses Persistent Pulmonary Fibrosis Induced by Ionizing Radiation in Mice. Int J Radiat Oncol Biol Phys. 2017 Oct 1;99(2):353-361. doi: 10.1016/j.ijrobp.2017.02.216. Epub 2017 Mar 4. PubMed PMID: 28479002.
- Roos CM, Zhang B, Palmer AK, Ogrodnik MB, Pirtskhalava T, Thalji NM, Hagler M, Jurk D, Smith LA, Casaclang-Verzosa G, Zhu Y, Schafer MJ, Tchkonia T, Kirkland JL, Miller JD. Chronic senolytic treatment alleviates established vasomotor dysfunction in aged or atherosclerotic mice. Aging Cell. 2016 Oct;15(5):973-7. doi: 10.1111/acel.12458. Epub 2016 Aug 5. PubMed PMID: 26864908; PubMed Central PMCID: PMC5013022.
- Childs BG, Baker DJ, Wijshake T, Conover CA, Campisi J, van Deursen JM. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 2016 Oct 28;354(6311):472-477. Epub 2016 Oct 27. PubMed PMID: 27789842; PubMed Central PMCID: PMC5112585.
- Baker DJ, Childs BG, Durik M, Wijers ME, Sieben CJ, Zhong J, Saltness RA, Jeganathan KB, Verzosa GC, Pezeshki A, Khazaie K, Miller JD, van Deursen JM. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 2016 Feb 11;530(7589):184-9. doi: 10.1038/nature16932. Epub 2016 Feb 3. PubMed PMID: 26840489; PubMed Central PMCID: PMC4845101.
- Demaria M, O’Leary MN, Chang J, Shao L, Liu S, Alimirah F, Koenig K, Le C, Mitin N, Deal AM, Alston S, Academia EC, Kilmarx S, Valdovinos A, Wang B, de Bruin A, Kennedy BK, Melov S, Zhou D, Sharpless NE, Muss H, Campisi J. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discov. 2017 Feb;7(2):165-176. doi: 10.1158/2159-8290.CD-16-0241. Epub 2016 Dec 15. PubMed PMID: 27979832; PubMed Central PMCID: PMC5296251.
- Chinta SJ, Woods G, Demaria M, Rane A, Zou Y, McQuade A, Rajagopalan S, Limbad C, Madden DT, Campisi J, Andersen JK. Cellular Senescence Is Induced by the Environmental Neurotoxin Paraquat and Contributes to Neuropathology Linked to Parkinson’s Disease. Cell Rep. 2018 Jan 23;22(4):930-940. doi: 10.1016/j.celrep.2017.12.092. Epub 2018 Jan 28. PubMed PMID: 29386135; PubMed Central PMCID: PMC5806534.
- Zhang P, Kishimoto Y, Grammatikakis I, Gottimukkala K, Cutler RG, Zhang S, Abdelmohsen K, Bohr VA, Misra Sen J, Gorospe M, Mattson MP. Senolytic therapy alleviates Aβ-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer’s disease model. Nat Neurosci. 2019 May;22(5):719-728. doi: 10.1038/s41593-019-0372-9. Epub 2019 Apr 1. PubMed PMID: 30936558; PubMed Central PMCID: PMC6605052.
- Bussian TJ, Aziz A, Meyer CF, Swenson BL, van Deursen JM, Baker DJ. Clearance of senescent glial cells prevents tau-dependent pathology and cognitive decline. Nature. 2018 Oct;562(7728):578-582. doi: 10.1038/s41586-018-0543-y. Epub 2018 Sep 19. PubMed PMID: 30232451; PubMed Central PMCID: PMC6206507.
- Musi N, Valentine JM, Sickora KR, Baeuerle E, Thompson CS, Shen Q, Orr ME. Tau protein aggregation is associated with cellular senescence in the brain. Aging Cell. 2018 Dec;17(6):e12840. doi: 10.1111/acel.12840. Epub 2018 Oct 11. PubMed PMID: 30126037; PubMed Central PMCID: PMC6260915.
- Xu M, Palmer AK, Ding H, Weivoda MM, Pirtskhalava T, White TA, Sepe A, Johnson KO, Stout MB, Giorgadze N, Jensen MD, LeBrasseur NK, Tchkonia T, Kirkland JL. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 2015 Dec 19;4:e12997. doi: 10.7554/eLife.12997. PubMed PMID: 26687007; PubMed Central PMCID: PMC4758946.
- Hickson LJ, Langhi Prata LGP, Bobart SA, Evans TK, Giorgadze N, Hashmi SK, Herrmann SM, Jensen MD, Jia Q, Jordan KL, Kellogg TA, Khosla S, Koerber DM, Lagnado AB, Lawson DK, LeBrasseur NK, Lerman LO, McDonald KM, McKenzie TJ, Passos JF, Pignolo RJ, Pirtskhalava T, Saadiq IM, Schaefer KK, Textor SC, Victorelli SG, Volkman TL, Xue A, Wentworth MA, Wissler Gerdes EO, Zhu Y, Tchkonia T, Kirkland JL. Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine. 2019 Sep;47:446-456. doi: 10.1016/j.ebiom.2019.08.069. Epub 2019 Sep 18. PubMed PMID: 31542391.
- Yousefzadeh MJ, Zhu Y, McGowan SJ, Angelini L, Fuhrmann-Stroissnigg H, Xu M, Ling YY, Melos KI, Pirtskhalava T, Inman CL, McGuckian C, Wade EA, Kato JI, Grassi D, Wentworth M, Burd CE, Arriaga EA, Ladiges WL, Tchkonia T, Kirkland JL, Robbins PD, Niedernhofer LJ. Fisetin is a senotherapeutic that extends health and lifespan. EBioMedicine. 2018 Oct;36:18-28. doi: 10.1016/j.ebiom.2018.09.015. Epub 2018 Sep 29. PubMed PMID: 30279143; PubMed Central PMCID: PMC6197652.
Автор: Ariel VA Feinerman






