Очередное видео по химии или около того. Сегодня получаем сверхкритический флюид — состояние вещества, похожее одновременно на газ и на жидкость.
В школе нам всем усиленно вбивали в голову, что есть три состояния вещества — твердое тело, жидкость и газ. Про плазму сходу вспомнят уже не все, но сейчас нам это не надо. Следующий факт. Что будет, если нагревать жидкость под давлением? Температура кипения повысится. На этом хватит текста, сейчас видео, комментарии под катом.
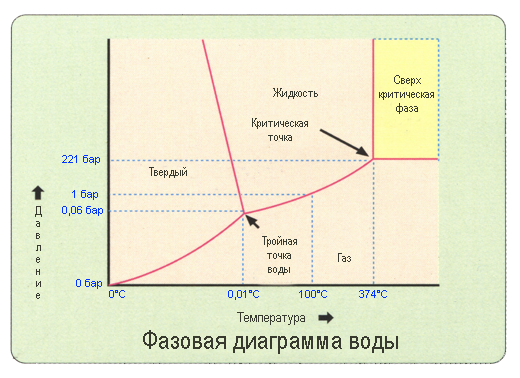
Фазовые переходы вещества описываются фазовой диаграммой в координатах температура — давление. Комнатная температура и атмосферное давление соответствуют жидкому состоянию воды. Если мы ее охладим, то при нуле градусов произойдет фазовый переход — жидкая вода превратится в лед. На диаграмме это видно как переход через границу раздела в другую область. При нагреве примерно до 100 по Цельсию вода закипит. Повышение точки кипения при повышении давления тоже вполне очевидно. Но ветвь диаграммы, соответствующая переходу жидкость — газ обрывается в так называемой критической точке. Для воды это 374 градуса Цельсия и 218 атмосфер. То есть можно перевести газ в жидкость, не совершая фазового перехода (кипения или конденсации) — состояние системы будет меняться плавно и без скачков. Закритическое состояние жидкости называется сверхкритический флюид. На диаграмме это обозначено как отдельная область, но это неправда. В бытовом смысле это скорее газ с плотностью как у жидкости. В то же время, флюид может выступать в роли растворителя.
На практике он используется как очень удобный экстрагент. Самое популярное применение — отмывка кофеина из кофе. Ввели в реактор с партией кофе жидкую углекислоту, нагрели выше критической точки (31 градус, 70 атм), дали пройти экстракции, слили, сбросили давление. Просто и экологично.

Без флюида не получится создать аэрогель. На молекулярном уровне он представляет собой очень ажурную сетку из атомов кремния и кислорода. Его можно синтезировать химически, осадив из водного раствора исходных веществ. Но удалить воду и сохранить при этом структуру аэрогеля можно только через флюид. Сначала воду заменяют на метанол простым вымачиванием, а затем переводят метанол в сверхкритическое состояние — у него оно более просто достижимо, чем у воды, структура аэрогеля это выдерживает. Потом флюид метанола испаряют и получают собственно аэрогель.
Для научно-популярных целей обычно получают флюид углекислого газа — он требует меньших давлений и комнатной температуры. Ссылка на Бена Краснова, который провел опыт в относительно большом объеме: benkrasnow.blogspot.com/2011/09/close-look-at-supercritical-carbon.html
Пара комментариев по опыту. Толстостенную стеклянную трубку, охлажденную жидким азотом, набили сухим льдом и быстро запаяли. Потом поместили на карантин в пенопластовый ящик, а выжившие нагрели градусов до 50 в теплой водичке. БОльшая часть при этом повзрывалась, так что без защиты глаз лучше не рисковать. В некоторых трубках углекислоты было совсем мало, а в некоторых наоборот — одна жидкость, без мениска. Угадать сколько сыпать сухого льда практически невозможно. С помощью аналогичного прибора можно получить сжиженный хлор или закись азота. Практической пользы никакой, но познавательно.
При осторожном нагреве трубки феном объем жидкости слегка увеличивается, а потом граница раздела просто исчезает. При обратном переходе сначала получается туманное кольцо, а потом внезапно флюид разделяется на жидкость и газ.
Автор: BubaVV
