Дисклеймер:
-
как и прежде я постараюсь максимально точно раскрыть тему и ответить на интересующие вопросы;
-
в первую очередь я пишу о том, что мне наиболее инетересно и что я сам хочу глубже узнать, однако, если у вас есть интересные вопросы, то можете предлагать их мне для следующих частей;
-
прошу отнестись с пониманием, что я физически не могу отвечать на все вопросы в комментариях в малейших деталях;
-
я не привожу ссылок на источники (за исключением отдельных), так как все приведенные в моей статье сведения могут быть элементарно проверены;
-
в комментариях я также стараюсь не приводить ссылки, так как если человек интересуется, то найдет, а если он просто хочет докапаться, то его мои ссылки не устроят.
Начать я бы хотел с разъяснения некоторых основ биологии, которые помогут в понимании как мРНК вакцин, так и аденовирусных векторных вакцин, о которых я рассказывал раньше. Также меня резонно упрекнули в слишком сильном упрощении ДНК-РНК мира, и первой частью своего рассказа я исправляю данную неточность.
Центральная догма молекулярной биологии - ДНК, РНК, белки
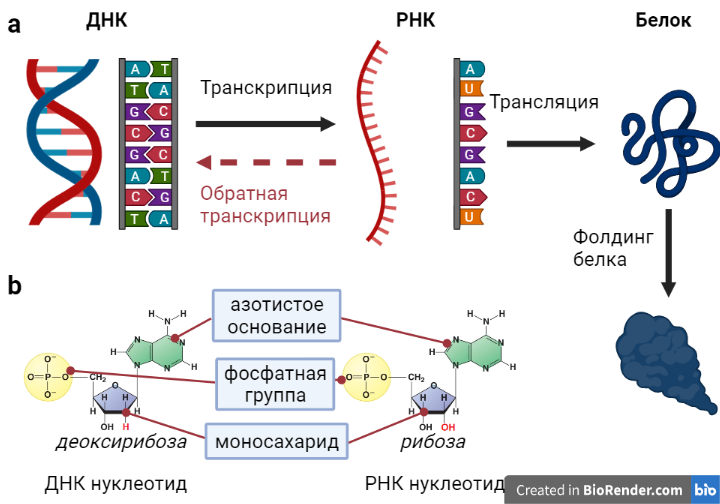
В начале 1950-х Фрэнсис Крик сформулировал центральную догму молекулярной биологии, которая и по сей день остается актуальной, но с некоторыми оговорками. Мы не будем вдаваться в частные случаи, которые не соответствуют центральной догме, а перейдем к общему описанию умозаключений Ф. Крика. Итак, в основе всей жизни на земле лежит информационный поток от ДНК к РНК (транскрипция) и от РНК к белку (трансляция) (Рисунок 1a). Частным случаем является обратная транскрипция, при которой информация передается от РНК к ДНК. В эукариотах (к которым относятся животные и растения) обратная транскрипция наблюдается крайне редко и связана прежде всего с ретротранспозонами (генетическое наследие вирусов) и теломеразой (специальный фермент). Зато вирусы используют этот механизм для внедрения своего генетического кода в человеческую ДНК; но это относится никак не к аденовирусам, а к ретровирусам, самым известным представителем которых является ВИЧ. После трансляции белок еще не представлен в своей окончательной форме, а проходит ряд модификаций (одна из которых фолдинг), чтобы принять свою законченную форму. Также, белки часто представлены не отдельной структурой, а составляют целые комплексы со множеством взаимодействующих белков.
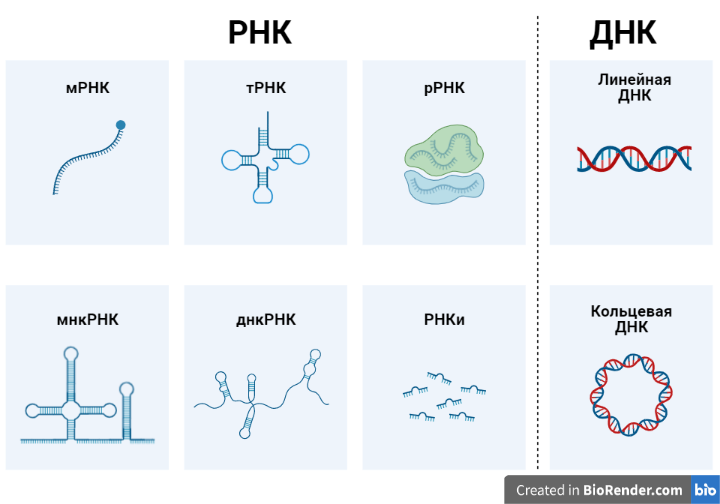
Так что же из себя представляют эти ДНК и РНК? В предыдущем посте я написал, что РНК представляет собой половину молекулы ДНК. Но на самом деле это не является определяющим отличием ДНК от РНК. Основное различие ДНК от РНК заключается в той основе, на которой они построены (Рисунок 1b): ДНК - дезоксирибоза, РНК - рибоза. В остальном они абсолютно подобны: обе имеют присоединенное азотистое основание и фосфатную группу. Общие азотистые основания ДНК и РНК - аденин (А), гуанин (G), цитозин (С); ДНК имеет тимин (Т), а РНК - урацил (U). По своей структуре ДНК в человеческих клетках представлен в основном в виде двух линейных антипараллельных цепочек, кодирующих наследуемую информацию в ядре (Рисунок 2). Также, в митохондриях (генерирует необходимую для клетки энергию) присутствует своя кольцевая двухцепочечная ДНК. Структура РНК в человеческом организме намного разнообразнее и представлена как линейной одноцепочечной молекулой в матричной РНК (мРНК) или при РНК интерференции (РНКи), так и различными по своему функционалу одноцепочечными РНК, которые могут составлять сложные трехмерные структуры (днк РНК - длинные некодирующие РНК, мнкРНК - малые некодирующие РНК, тРНК - транспортная РНК, рРНК - рибосомной РНК). Особую функцию несет мРНК - с нее как с шаблона делаются белки (тот самый S-белок тоже создается на мРНК). В то время как в клетках животных РНК ограничены одноцепочечным представлением, а ДНК ограничены двойной цепью, в вирусах присутствует полное разнообразие - ДНК и РНК в них представлены как в одноцепочечном представлении, так и в двухцепочечном.
мРНК вакцина
А теперь зная о том, как же все-таки появляются белки, давайте посмотрим свежим взглядом на аденовирусные векторные вакцины, где с ДНК вируса считывается сначала РНК, кодирующая шип белок, а потом по шаблону этой РНК создается множество копий S-белка.
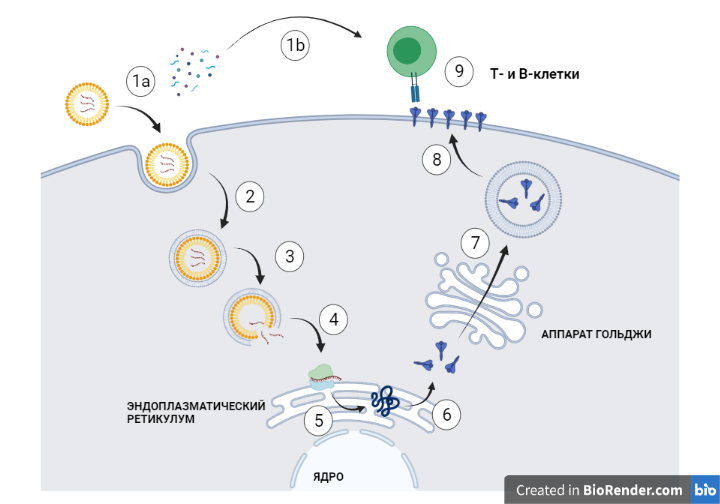
В мРНК вакцинах информация течет иначе, чем в аденовирусных векторных вакцинах. Итак, мРНК вакцина представляет собой липидную (жировую) оболочку, содержащую внутри ту самую мРНК, кодирующую S-белок. При непосредственном контакте клетки и липидной оболочки, липидная оболочка оказывается поглощенной клеткой (Рискнок 3.1а). Липидная оболочка с мРНК вводится совместно с веществами, которые призваны усилить иммунный ответ - адъювантами (Рисунок 3.1b). В дальнейшем мРНК вакцина дрейфует внутри клетки (Рисунок 3.2) до тех пор пока в связи с изменением pH липидная оболочка не окажется разорванной (Рисунок 3.3). Высвободившаяся мРНК попадает в эндоплазматический ретикулум (Рисунок 3.4) (специально организванное пространство в клетке), где в рРНК (из предыдущей части) комплексах с нее не происходит копирование протеина (Рисунок 3.5), который в дальнейшем будет свернут в рабочий S-белок (Рисунок 3.6). Доставки S-белка на поверхность клетки (Рисунок 3.8) обеспечивается с помощью аппарата Гольджи (Рисунок 3.7). На поверхности клетки иммунная система, заранее активированная адъювантами (Рисунок 3.1b), определяет его как чужеродный (Рисунок 3.9).
Казалось бы, что такого сложного сделать мРНК вакцину - берешь липидную оболочку и синтезированную мРНК S-белка? Проще же чем аденовирусная вакцина, или нет? Нет, не все так просто, когда нужно создать искуственную наноконструкцию с нуля. Существует ряд проблем, которые необходимо решить, чтобы создать мРНК вакцину:
-
Липидные наночастицы должны быть стабильны до того момента, пока не проникнут внутрь клетки.
-
Внутри клетки наоборот они должны эффективно освобождать мРНК.
-
Липидные наночастицы должны быть устойчивы как к окислительным агентам и действию ферментов (нуклеазы).
-
мРНК должны быть стабильны при длительном хранении
-
мРНК должны произвести большое количество S-белка, прежде чем быть уничтожены внутри клетки.
-
Произведенный S-белок должен эффективно взаимодействовать с иммунной системой, предоставляя иммуной системе для запоминания "правильные" эпитопы (об этом будет дальше).
При такой начальной сложности разработки у мРНК вакцин есть существенное преимущество перед аденовирусными векторными вакцинами - они достаточно просты в производстве. Также единожды разработанная технология по упаковке мРНК позволяет очень быстро разрабатывать последующие вакцин; достаточно просто "адаптировать" существующую мРНК под новый белок-антиген.
Выработка иммунитета
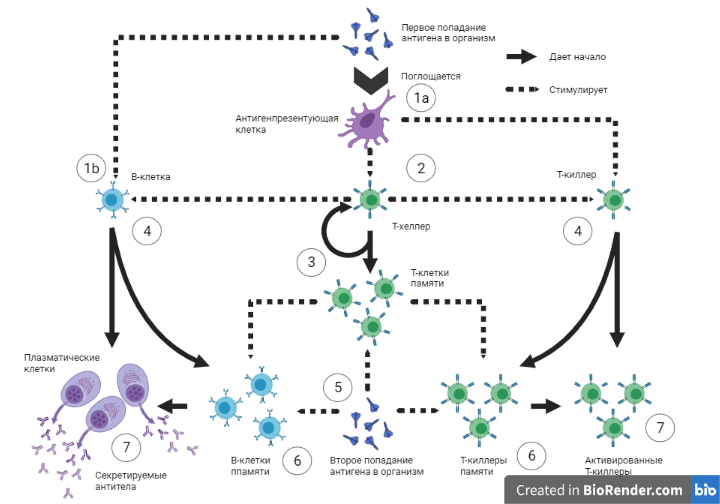
Что же происходит после того, как организм обнаруживает чужеродный белок, представленный на поверхности антиген-презентующей клетки (Рисунок 4.1а)? В ответ на чужеродные белок активизируются специализированные лимфоциты - Т-хелперы и Т-киллеры (Рисунки 4.2 и 4.4). Т-хелперы выпускают специальные сигнальные молекулы, которые активируют имунную систему и приводят организм в состояние готовности, а также помогают другим иммунным клеткам понять с каким инфекционным агентом они имеют дело. Т-киллеры при этом (Рисунок 4.7) определяют зараженные клетки и инициируют процесс контролируемой клеточной гибели; также они выпускают специальные молекулы, которые уничтожают вирусные частицы. Другой класс лимфоцитов, В-клетки, обеспечивают иной класс защиты от чужеродных частиц: при определении вирусного белока, они активизируются (Рисунок 4.1b) и через некоторое время могут трансформироваться в плазматическую клетку (Рисунок 4.8). При этом основная задача плазматической клетки - выработка специфических белков (антител) к конкретному патогену, которые блокируют функционирование патогена, а также помогают иммунной системе легче распознать недружественные элементы. Кроме всего прочего, Т-хелперы имеют способность усиливать и регулировать активность Т-киллеров и В-клеток (Рисунок 4.4). Т-хелперы обладают способностью становиться Т-хелперами памяти (Рисунок 4.3), которые долгое время могут помнить "сигнатуру" вируса и в любой момент могут перейти в активированную форму мобилизуя всю иммунную систему на войну с уже известным врагом. Т-киллеры и В-клетки также обладают способностью формировать клетки памяти (Рисунок 4.6) и хранить информацию о прошлых своих "мишенях". Т-хелперы в этом случае также помогают этим клеткам дольше сохранять знания о прошлых патогенах.
Так зачем же нужны две дозы вакцины, если клетки способные запоминать патогены? Особенность иммунной системы в том, что некоторые патогены наша иммунная система запоминает отлично, а вот другие плохо. Для того, чтобы усилить "иммунную память" и необходима вторая доза вакцины через определенный промежуток времени. При повторном попадании такого же или похожего патагена в организм (Рисунок 4.5) происходит активация уже существующих Т-хелперов памяти, Т-киллеров памяти и В-клеток памяти. При этом дополнительное усиление Т-хелперами памяти Т-киллеров и В-клеток. Таким образом, вызывается усиливающий каскад в иммунной системе, который мгновенно рекрутирует иммунную систему на противодействие (именно поэтому часто после второго укола наблюдается повышенная температура, головная боль и т.д.). При этом формируются более устойчивые клетки памяти.
S-белок
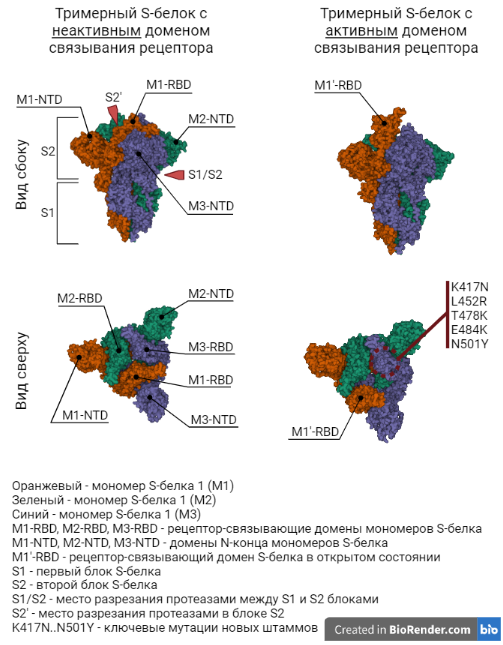
С глобальным механизмом работы иммунной системы мы разобрались. Но почему же ученые нацеливают иммунную систему на S-белок прежде всего? Почему нельзя взять за мишень какой-либо другой белок коронавируса? Для начала рассмотрим что же собой представляет S-белок. На Рисунке 5 приведена модель S-белка, который является достаточно крупным сам по себе - 180 kDa. Если вы были наблюдательными, то могли уже заметить, что сам S-белок представлен тремя мономерами (оранжевый, синий, зеленый), т.е. состоит из трех одинаковых белков. На виде сверху (левая часть) отлично видна симметрия тримера S-белка. И каждый мономер этого гигантского белка содержит в своем составе рецептор-связывающий домен (RBD-домен) и домен N-конца (NTD-домен).
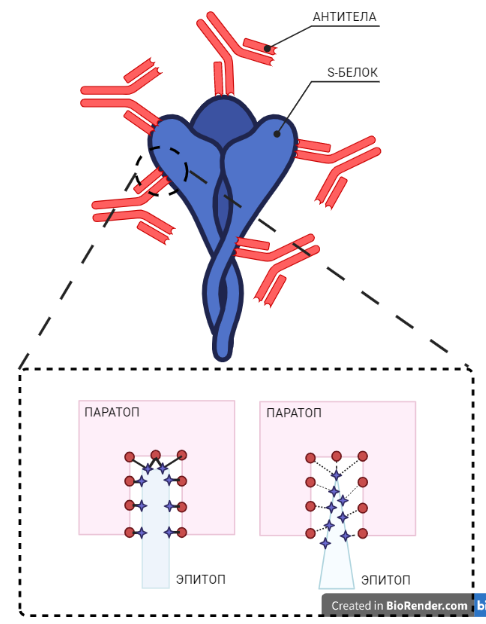
Так вот коронавирус использует S-белок для связывания с рецептором клетки и проникновения внутрь; без него вирус просто не сможет проникнуть внутрь клетки. И одной из важнейших компонентой этого механизма является RBD-домен, который распознает АСЕ2 рецептор и инициирует процесс проникновения внутрь клетки. Если заблокировать данный домен антителами, которые вырабатывают упомянутые выше плазматические клетки, то вирус перестанет распространяться. Чтобы понять, как работает блокирование S-белка антителами давайте обратимся к Рисунку 6. На нем изображен тримерный S-белок и антитела, которые к нему прикрепились. Нейтрализующие антитела содежат два конца, которыми они могут прикрепляться к патогену и блокировать его. Участок, который находится на патогене и опознается антителами называется эпитоп; участки на концах антитела, которые опознают патоген называются паратопами. Если мы идем в микромир клеток и белков, то очевидные нам явления и обычная житейская логика перестают существовать. Этот мир подчиняется законам, где даже слабые водородные и электростатические силы начинают играть роль. Кстати, а хотите статью, в которой бы рассказывалось об особенностях существования микромира клетки?
Соединение эпитопа и паратопа, как и любых белков внутри клетки, обсуловлено прежде всего слабыми взаимодействиями - электростатические, водородные, ван-дер-ваальса и гидрофобные связи. Это очень слабые связи и на них очень сильно влияет расстояние между двумя аминоксилотами (из них состоят протеины), а также само количество этих связей. Для того, чтобы антитело распознало эпитоп достаточно всего лишь 4-12 аминокислот. На Рисунке 6 внизу показано, что одни паратопы подходят к эпитопам, как детали конструктора (Рисунок 6, слева) и формируют более крепкие связи, а другие из-за их конфигурации не могут создать устойчивую пару (Рисунок 6, справа).
На Рисунке 5 справа изображен тот же самый тримерный S-белок, но с одной особенностью - один из RBD-доменов находится в активированом состоянии (M1'). Такая активация кроме того, что изменяет 3д структуру белка и прячет некоторые известные иммунной системе эпитопы, также усиливает возможность S-белка связываться с рецептором клетки. Такая активация S-белка просходит под воздействием протеаз (специальный фермент) не только в RBD-домене (S2'), но и между двумя структурным частями (S1/S2). Эти структурные изменения связывают в коронавирусе с его патогенностью.
Также как и RBD-домен должен быть достаточно специфичен к АСЕ2 рецептору, чтобы проникнуть внутрь клетки (а изменения в RBD-домене S-белка улучшают его возможность связываться с АСЕ2 рецептором), так и нейтрализующее антитело должно быть специфично к S-белку, а именно к RBD-домену. Размер всего S-белка составляет 1273 аминокислоты, RBD-домена - 222 аминокислоты и NTD-домена - 292 аминокислоты (размер распозноваемого эпитопа при этом 4-12 аминокислот). Таким образом на S-белке и его доменах может находиться множество эпитопов для антител, и иммунные клетки производят антитела сразу ко множеству эпитопов.
Я не зря упоминаю NTD-домен, так как нейтрализующие антитела к нему тоже блокируют возможность вируса проникать внутрь клеток. Однако, так как RBD-домен используется как своеобразный "ключ" и от его пространственной конфигурации зависит его возможность отпереть "замок" (АСЕ2 рецептор), то мутации, сильно изменяющие данный участок S-белка, приводят к потере возможности проникать внутрь клетки. С другой стороны, мутации NTD-домена не так сильно сказываются на способность коронавируса проникать внутрь клетки и следовательно этот домен мутирует намного сильнее, "пряча" S-белок от нейтрализующих антител. Таким образом, основной целью оказывается RBD-домен и мутации как раз в нем (Рисунок 5, правая нижняя картинка) связывают с возникновением наиболее сильных штаммов вируса: B117(Английский) ключевая мутация N501Y; B1351(Южноафриканский) - N501Y, E484K, K417N; P1(Бразильский) - N501Y, E484K; B1427-9(Калифорнийский) - L452R; B1671(Индийский) - E484K, L452R; B1.1.222(Мексиканский) - T478K.
В статье Effects of common mutations in the SARS-CoV-2 Spike RBD domain and its ligand the human ACE2 receptor on binding affinity and kinetics было определено, что мутации в RBD-домене N501Y и S477N повышают трансмиссивность вируса, мутации K417N/T в том же домене усиливают способность избегать иммуную система, а мутация E484K приводит и к тому и к другому. В той же статье была оценена способность вируса заражать клетки. При оценке способности вируса заражать клетки оценивается возможность S-белка взаимодействовать с АСЕ2 рецептором, которая определяется константой диссоциации. Константа диссоциации (Kd) в биохимии это специфическая константа равновесия, которая определяет возможность крупного объекта разделиться (обратимо) на более мелкие объекты. Так вот, для немутировавшего RBD-домена Kd = 74.4 нМ (наномолей), для мутации N501Y Kd = 7.0 нМ, т.е. при такой мутации RBD-домен S-белка в 10.5 раз сильнее связывается с АСЕ2 рецептором. Для бразильского штамма (E484K/N501Y) эта константа составляет 5.1 нМ, т.е. в 14.5 раза сильнее. В то время как мутация K417N увеличивает константу диссоциации до 364 нМ.
Универсальная вакцина
Так все же, мы теперь будем вынуждены вечно колоть себе вакцину от возникающих новых штаммов, когда провалим вакцинацию всего населения Земли? У меня есть надежда, что нет. Еще в 2017 году ученые начали разработку универсальной вакцины от коронавирусов (да-да, не одного а многих), но из-за нехватики финансирования работы шли медленно. И вот глобальная пандемия помогла толкнуть эти разработки но новый уровень. На данный момент прорабатываются многие варианты для борьбы с коронавирусами.
Одной из многообещающих вакцин является вакцина, содержащая S-белки с разными RBD-доменами (как мы помним NTD-домены не подходят на эту роль из-за их мутационной изменчивости) к наиболее опасным/новым штаммам вируса, а также к другим представителям семейства коронавирусов (MERS-CoV и SARS-CoV-1). Полагаю, что развитие компьютерного моделирования взаимодействия между S-белком и АСЕ2 рецептором поможет предугадать и предсказать новые потенциально опасные мутации RBD-домена. И можно будет действовать на опережение. Опять же разные S-белки в вакцине смогут помочь выработать иммунитет к мутациям коронавируса. мРНК вакцины отлично подходят для такого применения из-за их сравнительно нетрудозатрадной перестройке под другую мРНК.
Другим разрабатываемым оружием против коронавируса может стать вакцина, состоящая из различных RBD-доменов, закрепленных на наночастице. Такая вакцина будет стимулировать клетки иммунитета распозновать только определенные RBD-домены.
Очень обещающей может быть вакцина с одним универсальным эпитопом или RBD-доменом, которая покроет целое семейство коронавирусов. Разработки в этой области идут и, возможно, через какое-то время свет увидит пан-коронавирусная вакцина, которая защитит не только от SARS-CoV-2, но и от MERS-CoV и SARS-CoV-1.
До сих пор не было создано никакого специфического лечения от коронавирусной инфекции, а все медицинские манипуляции сводились только к поддерживающей терапии. Однако, потенциальным лечением (хоть и дорогим пока что) является лечение нейтрализующими антителами. Да, такими же точно антителами, которые производят наши плазматические клетки. Все отличие заключается в том, что можно заранее создать достаточный объем нейтрализующих антител (которые спроектированы для блокирования S-белка коронавируса) и доставить их в организм для борьбы с коронавирусом, а не ждать пока иммунная система распознает патоген и начнет производить собственные. На данный момент было показано, что применение нейтрализующих антител на ранних стадиях развития заболевания приводит к более легкому течению болезни, в то время как применение антител на поздних стадиях заболевания не принесло сколь бы то ни было статистически значимого улучшения. Нейтрализующие антитела также можно спроектировать для определения заранее заданного RBD-домена.
Это продолжение моего рассказа, в котором я вас знакомлю с вакцинами против коронавируса и их механизмами действия. В ней я погружаюсь глубже в недра молекулярной биологии, чтобы познакомить вас с центральной догмой, а также со структурой S-белка и его взаимодействием с антителами. Ну и напоследок мы немного пофантазируем на тему создания универсальной вакцины.
Автор: Alex_Mtrskn








