Написание статей о классических cognitive enhancers идёт медленнее, чем хотелось. Зато могу поделиться информацией о том, как низкомолекулярные регуляторы (так иногда называют классические органические лекарственные молекулы) могут влиять на память на уровне ДНК. Прошу засчитать эту статью как рассказ о ноотропных препаратах «иных классов».
Позволю себе переиначить классические определения.
Генетика изучает влияние первичной структуры ДНК, то есть её нуклеотидного состава, на фенотип. Таким образом, генетические изменения – это изменения, связанные с превращением одних азотистых оснований в другие, их выпадением, вставкой и изменением их последовательности.
Влияние на фенотип изменений в структуре ДНК более высокого порядка, т.е. не связанных с качеством и последовательностью соединения азотистых оснований, изучает эпигенетика от греческого epi- что значит над.
Я не буду приводить классические примеры, а перейду сразу к конкретным приложениям, связанным с регулированием памяти. Не без теоретического введения, конечно.
ДНК в клетке упакована очень плотно. Если бы эта огромная молекула (длина всех 46 хромосом в развёрнутом состоянии 2 м) не была упакована так плотно, то клеточный метаболизм был бы очень затруднён, так как ферменты бы запутывались в её цепях.
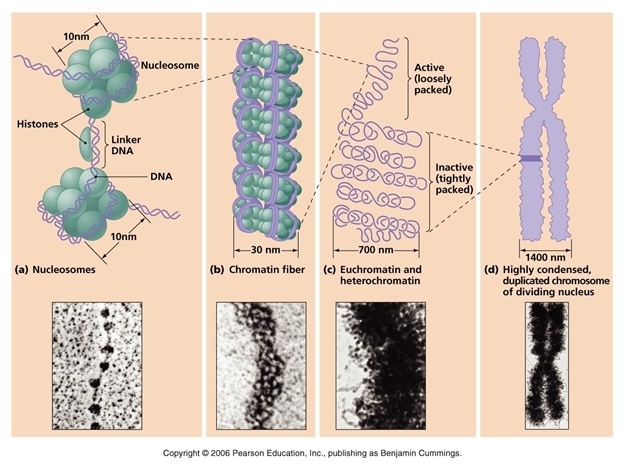
Уровни упаковки ДНК в клетке.
Упаковке ДНК помогают специальные белки – гистоны, которые образуют нуклеосому – структуру, на которую наматываются цепи ДНК.
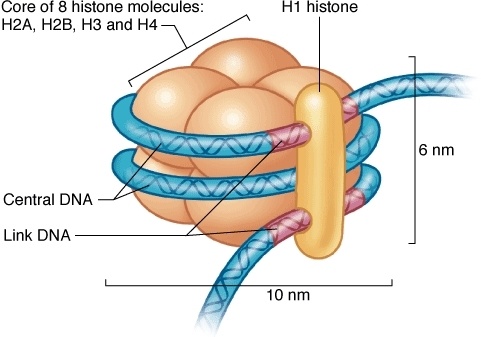
Нуклеосома.
Отличительной особенностью гистонов является наличие в них большого количества оснОвных аминокислот, которые в физиологических условиях заряжены положительно – лизина и аргинина.
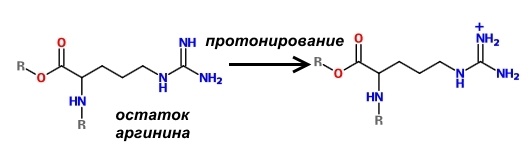
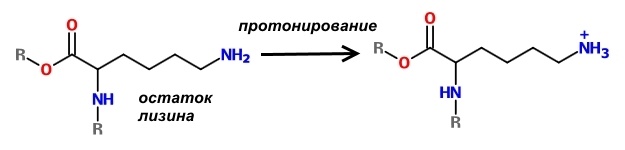
Поскольку молекулы ДНК заряжены отрицательно, то за счёт электростатического притяжения обеспечивается их плотное прилегание к нуклеосоме. Конечно, вся ДНК не может быть упакована плотно, иначе бы считывание с неё информации для синтеза белков было бы невозможно. Части её молекул не прилегают к нуклеосомам и доступны для РНК-полимераз.
Помимо всего прочего, степень связывания ДНК с нуклеосомами регулируется положительным зарядом гистонов. Если он повышается, упаковка ДНК уплотняется и наоборот. Существует и специальный комплекс ферментов, который «дежурит» у свёрнутой ДНК и разворачивает её при необходимости синтеза белка, который закодирован на её плотно упакованном участке.
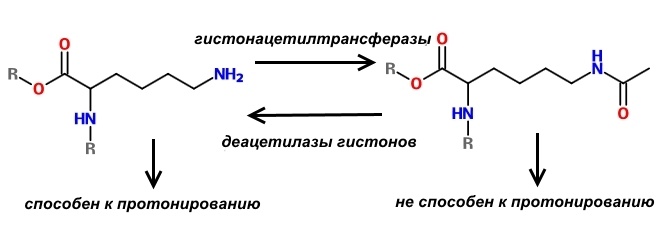
Один из способов регуляции заряда нуклеосом состоит в модификации оснОвных аминокислот, слагающих гистоны. Существуют специальные ферменты – гистонацетилтрансферазы, которые ацетилируют лизин, т.е. присоединяют к нему остатки уксусной кислоты. В результате такой модификации аминокислота теряет способность к протонированию, а, значит, не может заряжаться положительно. В результате связь ДНК с нуклеосомой ослабевает и хранитель информации становится доступным для РНК-полимеразы, что способствует экспрессии генов.
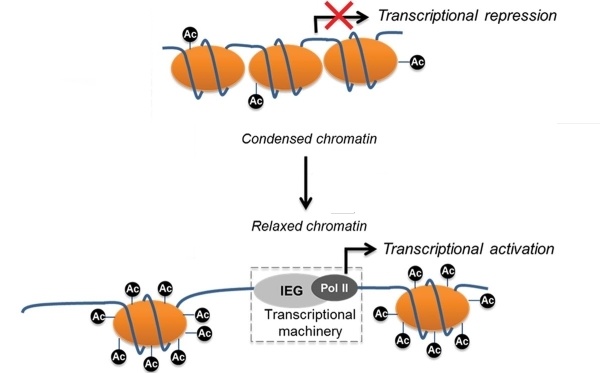
Логично предположить, что существуют и ферменты, которые «снимают» ацетильные остатки с лизина, входящего в состав гистонов. Действительно, такие ферменты найдены. Они называются деацетилазами гистонов; насчитывается 4 класса таких ферментов.
Пока всё это кажется очень далёким от памяти, но позвольте мне продолжить.
Может, кто-то помнит, что в основе долговременной памяти лежит нейрофизиологический процесс, в результате которого часто и длительно коммуницирующие нейроны отращивают дополнительные синапсы для усиления связи друг с другом – долговременная потенциация.
Отращивание этих синапсов происходит под действием белка BDNF, количество которого в постсинаптичсеком нейроне возрастает в результате активации его транскрипции под действием фосфорилированного CREB.
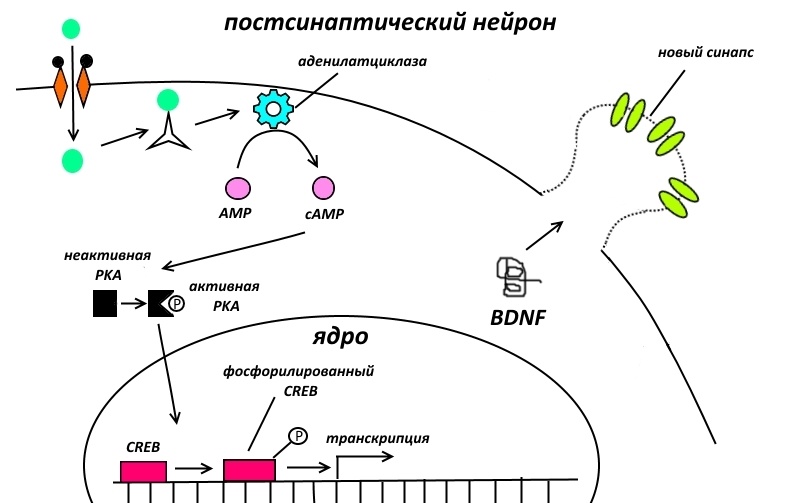
Таким образом, если участок ДНК, кодирующий BDNF, будет менее прочно связан с нуклеосомами, то экспрессия соответствующего белка, а, значит, и память, усилятся.
Ослабить связь нуклеосом с ДНК можно путём ингибирования деацетилаз гистонов. Теперь осталось привести конкретные примеры таких ингибиторов.
Простейшим ингибитором деацетилаз гистонов является бутират натрия, или натриевая соль масляной кислоты.
Проверку его действия проводили в опыте, который называется «fear conditioning».
В ходе опыта животное (крысу или мышь) сажают в клетку с электрифицированным полом, после чего ударяют током (удар током можем сопровождаться, например, звуковым сигналом).
Спустя некоторое время животное снова помещают в клетку, дают звуковой сигнал и фиксируют признаки поведения, связанные со страхом. Одним из характерных признаков является замирание («freezing»). Если животное проявляет больше этих признаков, чем контрольное, которому вводили плацебо, то это означает, что оно лучше помнит удары током.
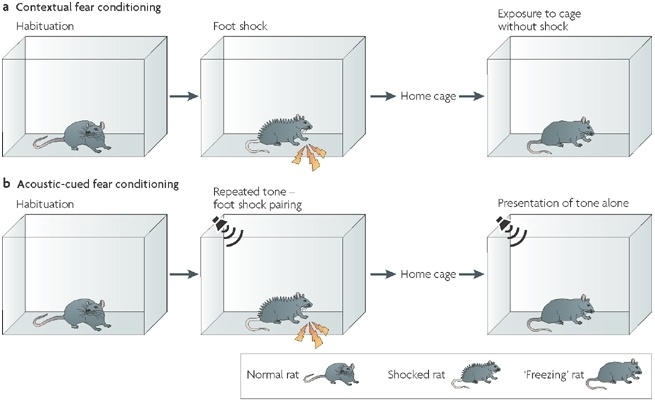
Контрольное животное через 24 часа забывает об ударах током и почти не демонстрирует признаков страха. Опытное животное, которому вводили бутират натрия, всё помнит и замирает в течение существенно большего периода времени наблюдения.
Как проявляется замирание, являющееся показателем того, что животное испытывает страх, можно посмотреть по ссылке.
Животное замирает, когда свет активирует в его определённые молекулы (в эти моменты загорается лампочка).
Опыты по «fear conditioning» позволяют изучать эмоциональную память, за которую ответственно, главным образом, миндалевидное тело.
Однако ингибиторы деацетилаз гистонов усиливают и пространственную память, за которую отвечает гиппокамп. Эту разновидность памяти изучают в других опытах, например, водном лабиринте Морриса, но я не буду на них останавливаться.
Деацетилазы гистонов 3 из 4 классов содержат ион цинка, катализирующий гидролиз ацетилированного лизина. Если заблокировать этот ион, то фермент перестаёт работать, по такому механизму и работают многие ингибиторы. Ниже показано, как происходит комплексообразование одного из представителей ингибиторов с ионом цинка в активном центре фермента.
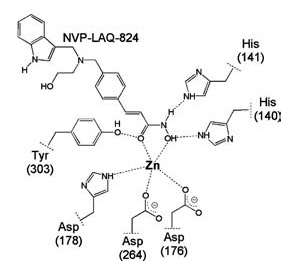
С точки зрения химии блокаторы деацетилаз гистонов можно разделить на несколько классов:
— гидроксамовые кислоты;
— циклические пептиды и подобные им соединения;
— бензамиды;
— эпоксикетоны;
— соли алифатических кислот.
Некоторые примеры приведены на рисунке.
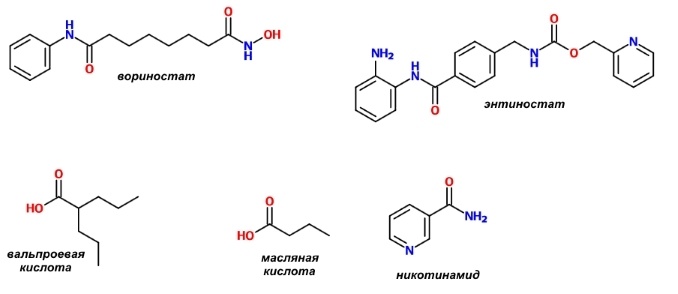
Ещё один класс рассматриваемых ферментов ингибируется никотинамидом, или витамином РР.
Таким образом, усиление памяти возможно не только посредством воздействия на рецепторы нейромедиаторов, но и с помощью усиления доступности ДНК, кодирующей BDNF, для транскрипционных факторов.
В настоящее время ведутся разработки, связанные с применением ингибиторов деацетилаз гистонов при нейродегенеративных заболеваниях и психических расстройствах, сопровождающихся угнетением когнитивной сферы.
Что почитать:
Jonathan M. Levenson, Kenneth J. O’Riordan, Karen D. Brown, Mimi A. Trinh, David L. Molfese, J. David Sweatt. Regulation of Histone Acetylation during Memory Formation in the Hippocampus// THE JOURNAL OF BIOLOGICAL CHEMISTRY. 2004, vol. 279, No. 39, p. 40454-40559.
http://www.jbc.org/content/279/39/40545.full.pdf
Iva B. Zovkic, Mikael C. Guzman-Karlsson, J. David Sweatt. Epigenetic regulation of memory formation and maintenance// Learning & Memory, 2013, vol. 20, p. 61-74
http://learnmem.cshlp.org/content/20/2/61.full.pdf
Mark Kilgore, Courtney A. Miller, Daniel M. Fass, Krista M. Hennig, Stephen J. Haggarty, J. David Sweatt, Gavin Rumbaugh. Inhibitors of Class 1 Histone Deacetylases Reverse Contextual Memory Deficits in a Mouse Model of Alzheimer's Disease// Neuropsychopharmacology, 2010, vol. 35, p. 870–880
http://www.nature.com/npp/journal/v35/n4/full/npp2009197a.html
Guan J.S., Haggarty S.J., Giacometti E., Dannenberg J.H., Joseph N., Gao J., Nieland T.J., Zhou Y., Wang X., Mazitschek R, Bradner J.E., DePinho R.A., Jaenisch R., Tsai L.H. HDAC2 negatively regulates memory formation and synaptic plasticity// Nature, 2009, vol. 459, p. 55-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3498958/pdf/nihms409622.pdf
Nigel Whittle, Nicolas Singewald. HDAC inhibitors as cognitive enhancers in fear, anxiety and trauma therapy: where do we stand?// Biochemical Society Transactions, 2014, vol. 42, p. 569-581.
http://www.biochemsoctrans.org/content/42/2/569
Автор: superhimik






