Можно сколько угодно говорить о том, что с медициной в России что-то не так, но защита потребителя у нас одна из лучших в мире. По сравнению с нашими европейские нормы по медицинским изделиям — это просто филькина грамота.
У нас в последние годы надо доказывать любой эффект. То есть, если вам встретилась мазь от морщин, а морщины она не убирает, можно пожаловаться в Роспотребнадзор. И где-то далеко на производстве послышится звук открываемой банки вазелина. Если вам поплохело после того, как вы приняли какой-нибудь лечебный бальзам, тоже можно жаловаться. И снова — чпок, к кому-то придут с проверкой.
Нас вся эта история ужесточения требований серьёзно коснулась пару лет назад, когда мы регистрировали Блефарогель. Но давайте я просто расскажу подробно сколько вазелина, слез и соплей мы потратили на этот процесс.
4 круга ада
Основа для регистрации медицинских изделий — это постановление № 1416.
Там описаны правила и порядок регистрации. Для того чтобы пройти эту довольно сложную процедуру, нужно провести следующие испытания:
- Токсикологические (доказывающие, что изделие безопасно с точки зрения материалов и используемых в формуле веществ).
- Технические (доказывающие, что изделие по своим свойствам и техническим характеристикам соответствует требованиям ТУ и эксплуатационной документации производителя, а также то, что процесс производства будет единообразен и не надо будет проверять каждый отдельный элемент партии).
- Клинические (доказывающие эффективность и безопасность решения медицинской задачи).
- И экспертизу качества, эффективности и безопасности, где комиссия собирает все данные по изделию в одну кучу и принимает решение о возможности его регистрации и выпуске на рынок.
Важный момент: по закону медицинское изделие не может лечить. То есть если оно оказывает лечебный эффект, то это лекарство, совершенно другая категория. Медизделие может быть чем-то вспомогательным в процессе. Например, если регистрируется тонометр, надо доказать, что он измеряет давление, что рукав в местах соприкосновения с кожей не вызовет аллергию или разные дерматиты, что давление будет измеряться с заданным допуском в течение всего срока эксплуатации прибора. В случае с какой-нибудь уткой надо доказывать её гипоаллергенность и безопасность для пациента. В случае с нашими гелями главное — пройти Росздравнадзор, в том числе токсикологию.
Раньше с токсикологией было относительно просто. Сегодня надо начать с аналитики компонентов и их взаимодействия. Что важно, касается это не только самого изделия, но и упаковки. Раньше проверили бы только гель, а сейчас по новым стандартам — гель и упаковку (флакон с крышкой) всех используемых фасовок и цветовой гаммы, а также их взаимодействие. Сделано это для того, чтобы вещества флакона не меняли свойства геля, мигрируя в его состав.
Сначала нужно провести литобзор, то есть найти информацию в виде статей и отзывов на зарегистрированные аналоги, доказывающую их эффективность и безопасность, найти практику по действующим веществам и доказать, что они в смеси безопасны.
Почему первый этап по литобзору? Напомню, что у нас не лекарство, а медизделие. Там не требуется испытывать новую формулу. Чаще всего.
Выглядит это так: ссылаемся на статьи для экспертизы, то есть находим в архивах журналы, нотариально заверяем скриншоты и копии, чтобы комиссия потом сама не искала.
Затем нужны отзывы из клинической практики по зарегистрированным аналогам. То есть мы должны найти публикации (или взять уже когда-то зарегистрированный ближайший аналог и проверить, как он решает эту задачу). На основании собранной информации о зарегистрированных аналогах оформляется акт оценки результатов клинических испытаний медицинских изделий.
Далее с пакетом документов, подтверждающих проведение всех этапов, указанных выше, а также с другими дополнительными документами на медицинское изделие направляемся в Росздравнадзор для регистрации.
Как проходит процесс
Сначала подаётся заявление и досье на будущее изделие в Росздравнадзор. В заявлении описывается назначение, класс риска, область применения и другая информация о медицинском изделии, а также данные о производителе. Кроме заявления, прикладывается комплект документов: протоколы, акты обо всех проведённых испытаниях, техническая документация (ТУ), эксплуатационная документация (инструкция по применению, этикетки), фотографические изображения, отчёт об анализе рисков, сведения о нормативной документации, акт квалификационных испытаний, а также договоры аренды и другие документы производителя.
То есть на момент подачи заявления надо закончить все внутренние тесты (у нас внутри производства в собственной лаборатории они делаются жёстче, чем в гослабораториях, потому что это элементарно выгоднее — заходить с первого раза и не сталкиваться с отзывами партий потом в процессе продаж). Потом сдать в одну из лабораторий с государственной аккредитацией токсикологию.
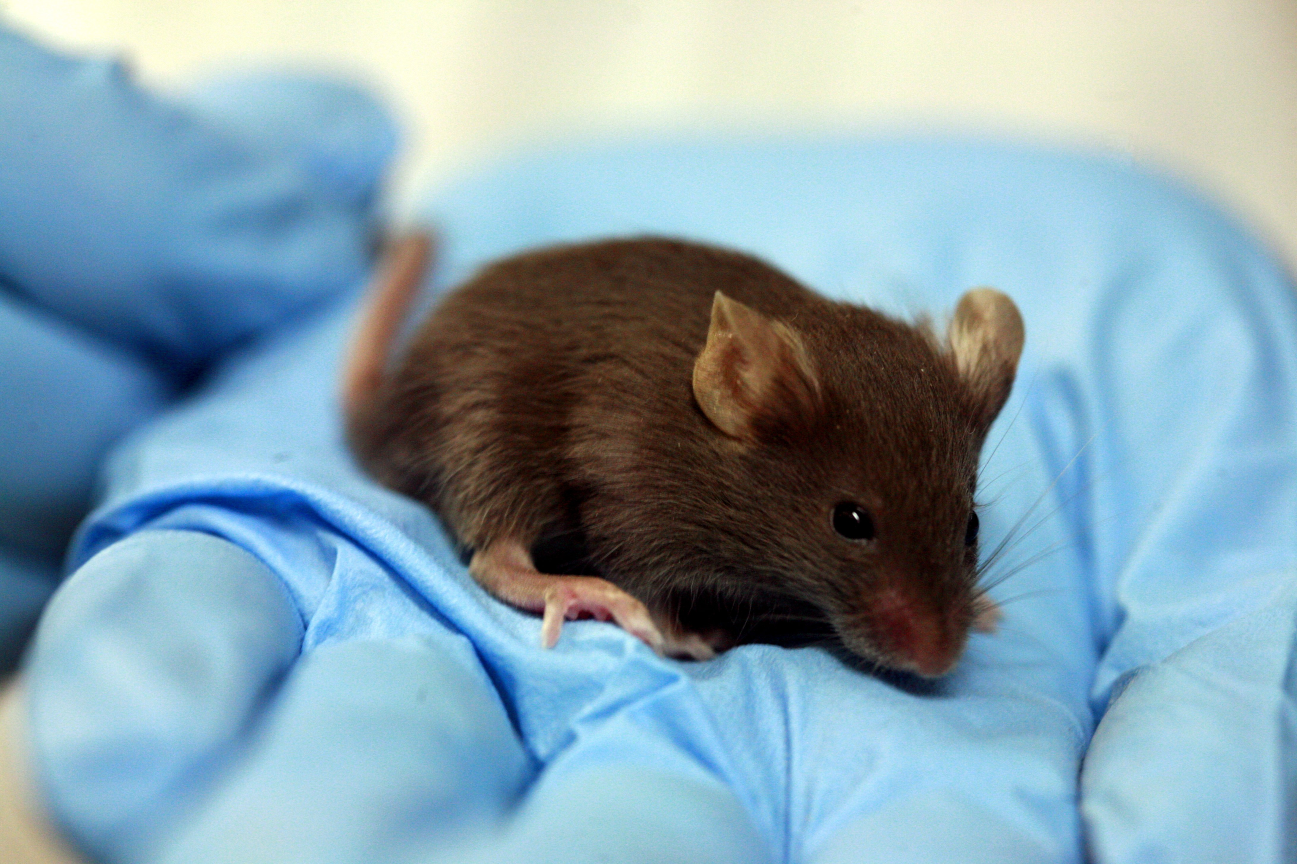
В нашем случае, например, Блефарогель (средство для гигиены век при профилактике синдрома сухого глаза) — это гель, который наносится на веки и кожу лица. На токсикологии были мыши. Что с ними точно делали, не знаю, но предполагаю, что выбривали два участка на каждом животном, один мазали гелем, второй оставляли или мазали чем-то нейтральным. И следили за мышкой. Внутрь мыши, к счастью, не пихали. (Ладно, почти не пихали — дело в том, что в паспорте безопасности [или MSDS — material safety data sheet] пропиленгликоля есть данные по смертельной дозе при приёме перорально. Его надо 4 грамма на мышь [её физически разрывает при этом, скорее всего]. И ведь как-то они эту дозу устанавливали…) Но вернёмся к более удачливым мышиным товаркам, которых просто мажут. У них есть соседки, которым достались чистые флаконы от средства, в которые наливают воду и отстаивают. Затем их мажут этой водой из флаконов, чтобы проверить, что пластик со временем не выпускает что-то опасное. Или нет: точная методика производителям не раскрывается, есть высокая вероятность, что эту воду из флакона просто химически анализируют и уже при подозрениях заносят внутрикожно.
Мышек нам жалко, но подход такой: если бы не наши тесты, они бы вообще не родились. В целом их там не мучают (по крайней мере, мы заходим уже с готовым исследованием на себе). Ещё мы знаем, что лаборанты испытывают к мышкам тёплые чувства, сравнимые с любовью деревенского жителя к курице. И мы подозреваем, что в конце исследований мышка не утилизируется окончательно, а отправляется на реабилитацию перед новыми тестами. Но это только теория: если здесь есть кто-то, кто может рассказать про их судьбу, то было бы замечательно.
К этой же заявке надо приложить технические исследования. Конкретно — написать ТУ (нормативный документ на медицинское изделие, устанавливающий технические требования) и доказать, что медицинское изделие ему соответствует. Эксперты согласовывают наши условия. Потом там же проверяется стабильность серийных образцов и соответствие их «досье» изделия: цвет, запах, электропроводность, ослабление УЗ-сигнала и так далее — всё то, что указано. На этой стадии часто требуют переформулировать то или иное слово в описании изделия. Тот же наш Медиагель имеет разную вязкость: это одно удостоверение регистрации, но три набора испытаний — для средней вязкости, более жидкого и более плотного геля.
Такие же регулярные проверки на соответствие ТУ мы проводим на собственном производстве. Всего один раз за всю практику был случай, когда мы приблизились к допустимым границам теста, обычно идём ровно по центру допусков между границами.
Класс риска изделия определяется по его назначению, способу применения, длительности применения, инвазивности и другим критериям. У нас у гелей для УЗИ, например, длительность контакта с кожей до одного часа — это первый класс. А во второй класс, например, попадают гинекологические зеркала, разные вещи для новорождённых.
Есть разница в клинических испытаниях. Первый класс — клинические испытания можно делать сразу. Второй класс и выше — клиника только после официального разрешения Росздравнадзора. До клинических испытаний команда разработки имеет право испытывать только на себе. Цель — убедиться в основном эффекте. Цель беты — понять возможные побочные эффекты и разные интересные случаи вроде «на фоне приёма других лекарств». Клинические испытания начинаются тогда, когда в теории доказана безопасность медизделия.
Отмечу, что если речь не про медизделие, а про косметику, то исследования ведутся на добровольцах в клиниках, имеющих аккредитацию на научные исследования такого типа.
На практике так: комиссия заканчивает анализ документов (за исключением медизделий 1-го класса риска применения и медизделий для диагностики in vitro), затем присылают письмо и дают 50 рабочих дней на то, чтобы провести клинические исследования и предоставить им результаты. По большинству наших гелей вся клиническая практика была получена ещё до ужесточения требований, поэтому сложностей никаких не было. Но вот сейчас у нас целевой заказ от офтальмологов на новый Блефарогель Форте — это как Блефарогель-2 с соединениями серы для демодекса, только для запущенных случаев. Если Блефарогель-1 — это «чтобы глаза не болели, пока я сижу за компьютером», Блефарогель-2 — «чтобы не было воспаления от клеща и ему нечего было есть на веках», то Блефарогель Форте будет «геноцид клещей любой ценой». В смысле, что мы сознательно повышаем опасность аллергии, увеличивая долю действующих веществ, но рекомбинируем формулу так, чтобы помогло в особо сложных случаях. Поскольку это делается по запросу врачей, которые только предвидят, что им нужно такое средство.
Конец эпопеи
Дальше проверяется полнота документов в Росздравнадзоре: выделяется консультант-исполнитель, который просто проверяет пакет. Документы сканируют и отправляют в экспертную организацию в ведомстве Росздравнадзора. В результате в Росздраве документально оформляется заключение на основе совокупности всех документов. Делает его экспертная группа. Если всё хорошо и документы друг другу соответствуют, то дальше дают разрешение на госрегистрацию.
С этого момента ничего трогать нельзя вообще. Заменить букву на этикетке либо заменить значок автоматически означает, что надо проходить перерегистрацию. Нас попросили как-то поменять этикетку Медиагеля-с на русско-английскую. Это значит проведение перерегистрации. Полгода ушло на то, чтобы внести английский текст.
Поскольку процесс экспертный, то во многом он связан с конкретными толкованиями довольно сложных норм. Это значит, что несколько раз вы можете подать документы по одной и той же схеме, а потом окажется, что будет нужна новая бумажка. В целом это некая случайность: могут завернуть на каждой переподаче. Старая госрегистрация при этом остаётся и никуда не девается, но мы теряем деньги на испытания и платим большую госпошлину даже за регистрацию и внесение изменений. И ещё тратим государственных мышей.
Дальше надо ждать приказа на бумаге. Когда будет приказ, изделие попадёт в реестр, то есть на сайт, на котором аптеки смотрят, что есть что. Только с этого момента можно что-то делать. Аптека не берёт изделия, которых нет в РУ Минздрава, если это не косметика, конечно.
Только в этот момент можно начинать производство. Без номера Минздрава не можем не только продавать, но даже производить в России.
Всё, начиная с этого момента мы делаем медизделие серийно. Из опыта: очень важно иметь развитую лабораторию контроля качества, потому что любая жалоба означает тщательную проверку на производстве (комиссии, судя по поведению, нельзя возвращаться без отчёта о хоть каких-то нарушениях) и остановку отгрузок. В этом плане мы предпочитаем проводить приёмо-сдаточные и периодические испытания самостоятельно и исследования на малых выборках перекрывать своими собственными. Я имею в виду, что 10 добровольцев из норматива — это мало, а вот 100 добровольцев — это уже более-менее репрезентативная выборка. В долговременной перспективе более масштабные исследования всегда окупаются, и для меня большая загадка, почему так не всегда делают другие производители.
В следующем посте я постараюсь рассказать про ещё один важный этап исследований — челлендж-тест: это когда образцы специально загрязняются патогенными бактериями. Эту часть исследований ни в коем случае нельзя делать где-то близко от производства или исследовательских лабораторий, поэтому челлендж-тесты выносятся наружу.
Автор: Елена Пастухова





