
Организм человека — это удивительный механизм, обладающий множеством функций. Однако далеко не все в нем идеально. Многие травмы или заболевания приводят к повреждениям, которые не поддаются заживлению ввиду ограниченной регенерации. К таким травмам относится повреждение спинного , что часто приводит к потере двигательных функций. Вылечить это невозможно, но технологии могут это изменить. Ученые из Оклендского университета (Новая Зеландия) разработали имплант, передающий слабые электрические токи непосредственно в поврежденные спинной
Основа исследования
Повреждение спинного
EF лечение берет свое начало в ранних исследованиях in vitro, показывающих, что стимуляция постоянным током может направлять и стимулировать регенерацию аксонов к катоду. Используя наборы электродов, пришитых к мышце над твердой мозговой оболочкой, этот подход затем продемонстрировал регенерацию аксонов, уменьшение дегенерации аксонов и восстановление мышечных рефлексов в перерезанном спинном
Затем было сделано усовершенствование, чтобы чередовать полярность стимуляции каждые 15 минут (~0.5 мГц), что способствовало росту аксонов в обоих направлениях, предотвращая при этом отмирание от анода. Это лечение было применено к собакам-пациентам, которым были имплантированы эпидуральные стимуляторы, что привело к значительному улучшению поверхностной и глубокой болевой реакции ниже поражения по сравнению с контрольной группой, тогда как неврологические показатели для передвижения и проприоцептивного размещения не были значительными.
Аналогичным образом, у пациентов с травмой спинного
Однако металлические электроды, доступные для этих предыдущих исследований, ограничивали прогрессирование парадигмы лечения низкочастотным EF, поскольку коррозия препятствовала их эффективности и потенциально генерировала токсичные концентрации побочных продуктов, таких как ионы металлов, изменения pH и активные формы кислорода, повреждающие местные ткани.
В рассматриваемом нами сегодня труде ученые вернулись к вышеописанной концепции, но с некоторыми улучшениями. В частности было решено использовать тонкопленочное производство, современные электродные материалы и субдуральное позиционирование для повышения мощности, точности и биосовместимости стимуляции. Ранее ученые разработали ультратонкий спинальный имплант для записи, который можно безопасно вставить под твердую мозговую оболочку для прямого контакта с пиальной поверхностью спинного
Ученые ожидают, что это позволит субдуральным электродам обеспечивать более сильную стимуляцию, используя на порядок меньшую входную мощность и, что важно, гораздо большее проникновение EF в спинной
Результаты исследования
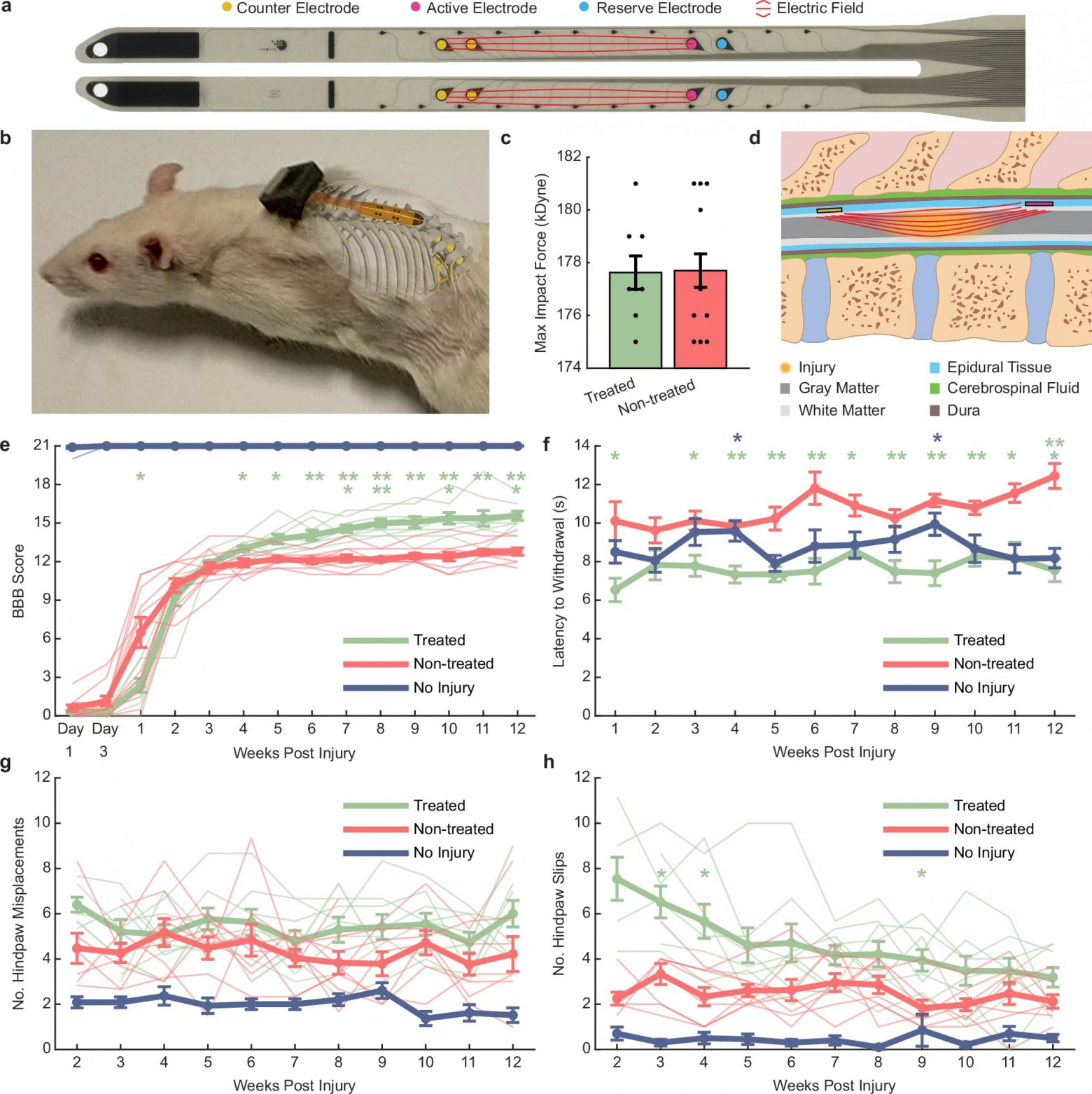
Изображение №1
Ученые проверили эффективность EF лечения бифазным 2 Гц (амплитуда 5 мкА, ширина импульса 250 мс) путем хирургической установки импланта в трех группах крыс (1a, 1b). Две из групп, обработанные (n=8) и не обработанные (n=10) получили травму от удара силой 175 килодина на границе между сегментами позвоночника L1/L2 (прямо под спинномозговым отростком T11). Максимальная сила (1c) ударов была одинаковой, а профили силы и времени были согласованными между двумя группами. Начиная со дня после операции, группа пациентов получала 1-часовую EF-терапию ежедневно в течение 7–11 дней, затем только по будням (5 дней в неделю) в течение 12 недель. Стимуляция проводилась с помощью электродов SIROF ∅ 200 мкм, расположенных по обе стороны от травмы (1d). Имплант также включал два резервных электрода, а также меньшие регистрирующие электроды, которые не были частью этого исследования (1a).
Функцию задних конечностей оценивали на 1, 3, 7 день после операции, а затем еженедельно, используя шкалу Бассо Битти Бреснахана (BBB от Basso Beattie Bresnahan) (0 = нет функции, 21 = нормальная функция), сравнивая баллы обработанных крыс с необработанными и контрольной группой без травм (n = 10). В течение первой недели после операции обработанная группа показала более медленное восстановление по сравнению с необработанной группой, со значительной разницей, наблюдаемой на 7 день (1e). Однако, начиная с 4 недели, обработанные крысы демонстрировали значительно более высокие баллы, что указывает на большее восстановление функции задних конечностей по сравнению с необработанными контрольными группами. Кроме того, обработанные крысы продолжали демонстрировать улучшение, со значительно более высокими баллами с 8 по 12 неделю по сравнению с их баллами на 5 неделе. Напротив, необработанные SCI крысы вышли на плато на 5 неделе и не показали дальнейшего улучшения. К 12 неделе 100% обработанных крыс набрали 14 или выше, что указывает на постоянную координацию между передними и задними конечностями, по сравнению с всего 20% необработанных крыс.
Оценка восстановления механической чувствительности была выполнена с помощью электронного теста фон Фрея, в котором тонкая металлическая нить прикладывала нарастающую силу (2.5 г/с) к подошвенной поверхности задних лап. Обработанные крысы отдергивали лапы быстрее на 1-й и 3–12-й неделе по сравнению с необработанной группой, что указывает на восстановление тактильной чувствительности (1f). Кроме того, обработанные крысы имели более высокие показатели отдергивания, чем контрольные животные без травм на 4-й и 9-й неделе. Это различие может быть связано с высокой изменчивостью этого теста при назначении его неповрежденным крысам, но это также может указывать на степень гиперчувствительности в лапах обработанных животных.
Животные также проводили еженедельные сессии, в ходе которых они пересекали горизонтальную лестницу (1 м), и подсчитывалось количество смещений задних лап и соскальзываний. Это задание было предпринято только после того, как животные опирались на обе задние лапы (неделя 2 или 3). Не было никакой разницы в количестве смещений лап между обработанными и необработанными контрольными крысами (1g). Обработанные крысы имели большее количество соскальзываний по сравнению с необработанными крысами на 3, 4 и 9 неделе (1h).
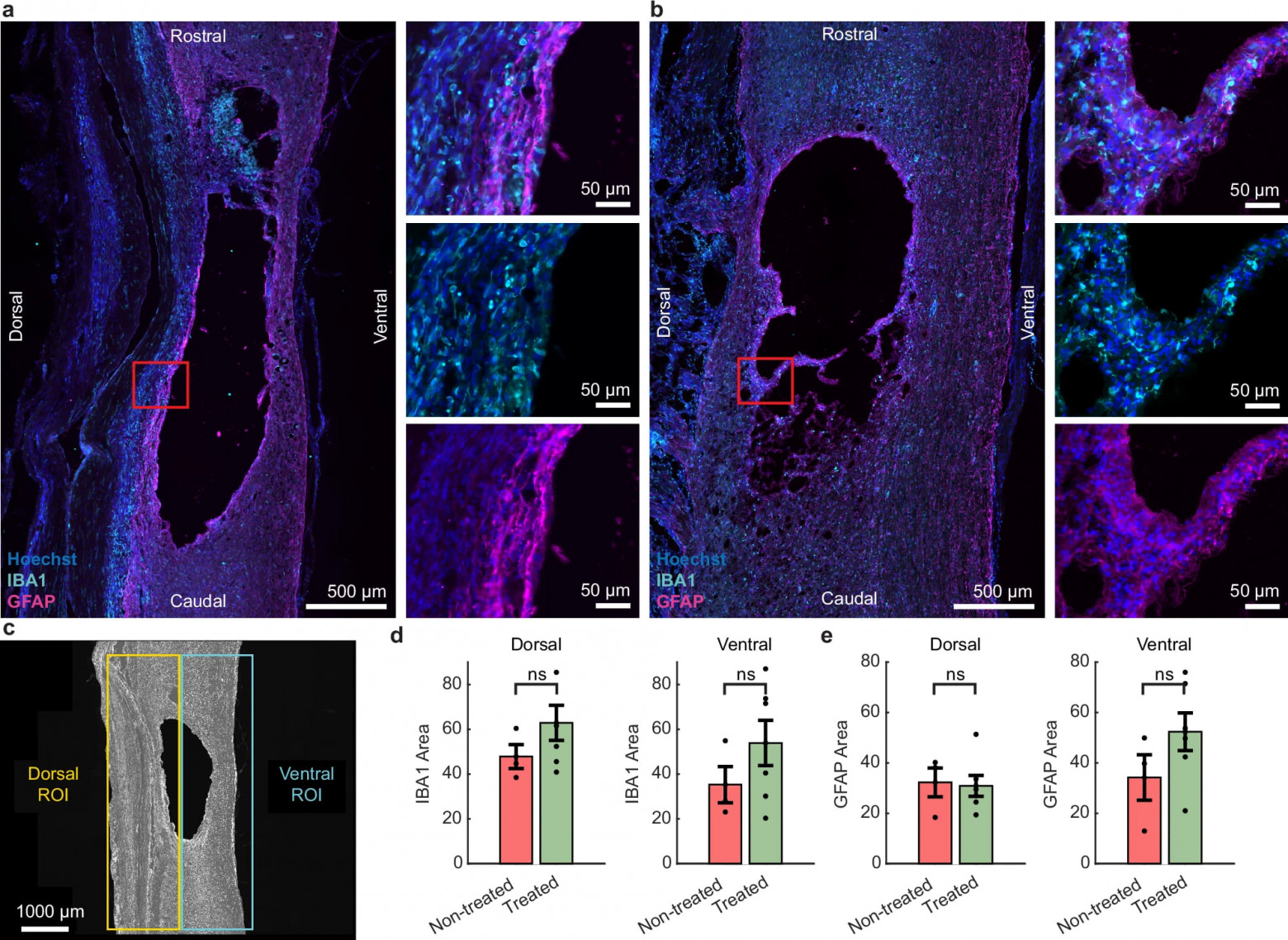
Изображение №2
По истечении 12 недель крысы были перфузированы, и сагиттальные продольные срезы вокруг повреждения были проанализированы как в обработанных, так и в необработанных группах. Размер и степень поражения соответствовали предыдущим исследованиям с использованием аналогичных моделей повреждения. В предыдущей работе на неповрежденных крысах результаты показывают, что имплант не вызывает значительного иммунного ответа. В настоящем исследовании ученые сначала изучили, привело ли субдуральное EF лечение к нейровоспалительным изменениям под электродами, изучив маркеры, связанные с микроглией и астроцитами (2a, 2b). Эпидуральное EF лечение ранее было связано с увеличением и уменьшением нейровоспаления, тогда как субдуральное лечение еще не было оценено. Поскольку ток стимуляции ослабевает по мере того, как он течет вентрально из-за сопротивления тканей, генерируемая сила EF будет выше в дорсальных, чем вентральных областях. Если EF лечение влияет на нейровоспаление, можно было бы ожидать более выраженных эффектов в дорсальных, чем в вентральных областях. Поэтому дорсальные и вентральные области интереса (ROI от region of interest), показанные на 2c, были проанализированы по всем гистологическим оценкам в этом исследовании (каждая 7.1 мм2). Не было обнаружено существенных различий в активности микроглии/макрофагов между группами с сопоставимыми уровнями экспрессии Iba1 (2d). Кроме того, не было никаких доказательств астроглиоза в ответ на лечение, поскольку уровни глиального фибриллярного кислого белка (GFAP от glial fibrillary acidic protein) оставались схожими между группами (2e).
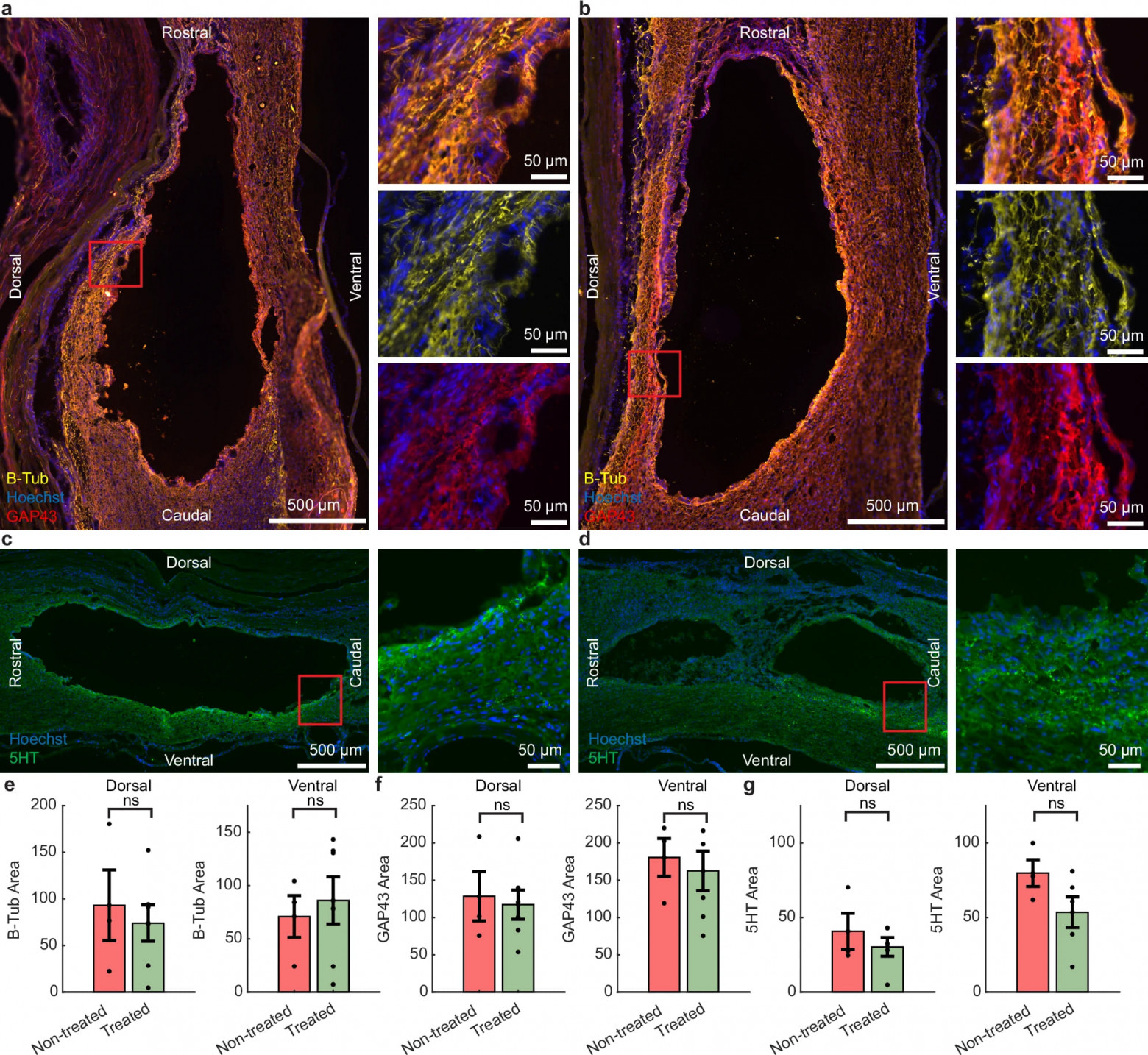
Изображение №3
Иммуногистохимия для β-тубулина III (β-tub) и белка роста 43 (GAP43) была проведена для оценки плотности аксонов и признаков недавней регенерации аксонов соответственно (3a, 3b). Серотонинергическая экспрессия также была исследована вокруг места поражения (3c, 3d). Через 12 недель не было никаких наблюдаемых изменений в экспрессии β-tub (3e) или экспрессии GAP43 (3f) в поврежденной ткани между группами. Не было отмечено существенной разницы в серотонинергической экспрессии у обработанных животных (3g).
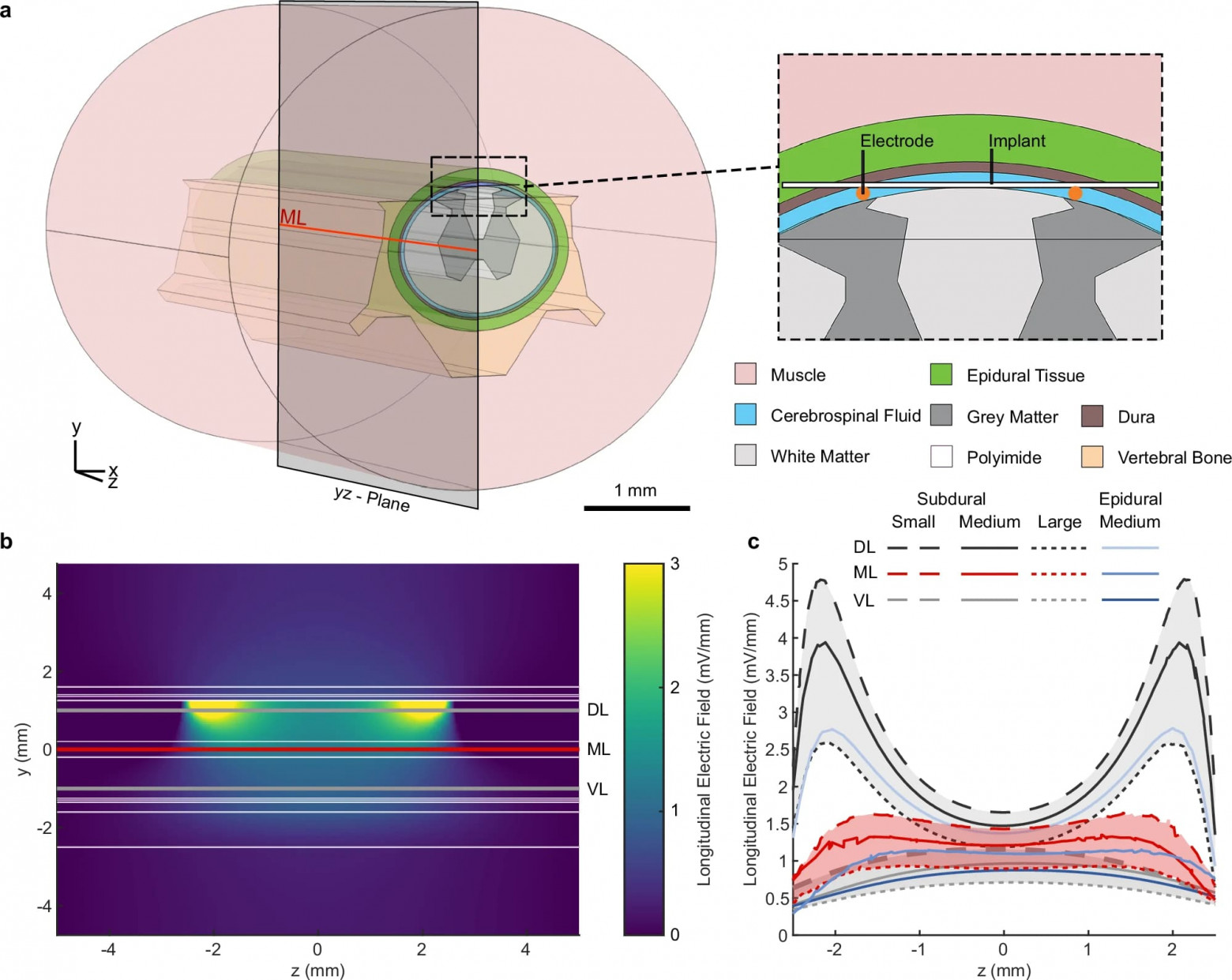
Изображение №4
Затем была проведена оценка эффективности тока стимуляции в создании терапевтической силы EF с помощью модели конечных элементов позвоночника крысы (4a). Модель использовалась для оценки силы EF с изменениями в размере белого вещества и объеме субарахноидального пространства, содержащего спинномозговую жидкость (CSF от cerebrospinal fluid), для оценки влияния размера спинного
Было смоделировано три размера спинного
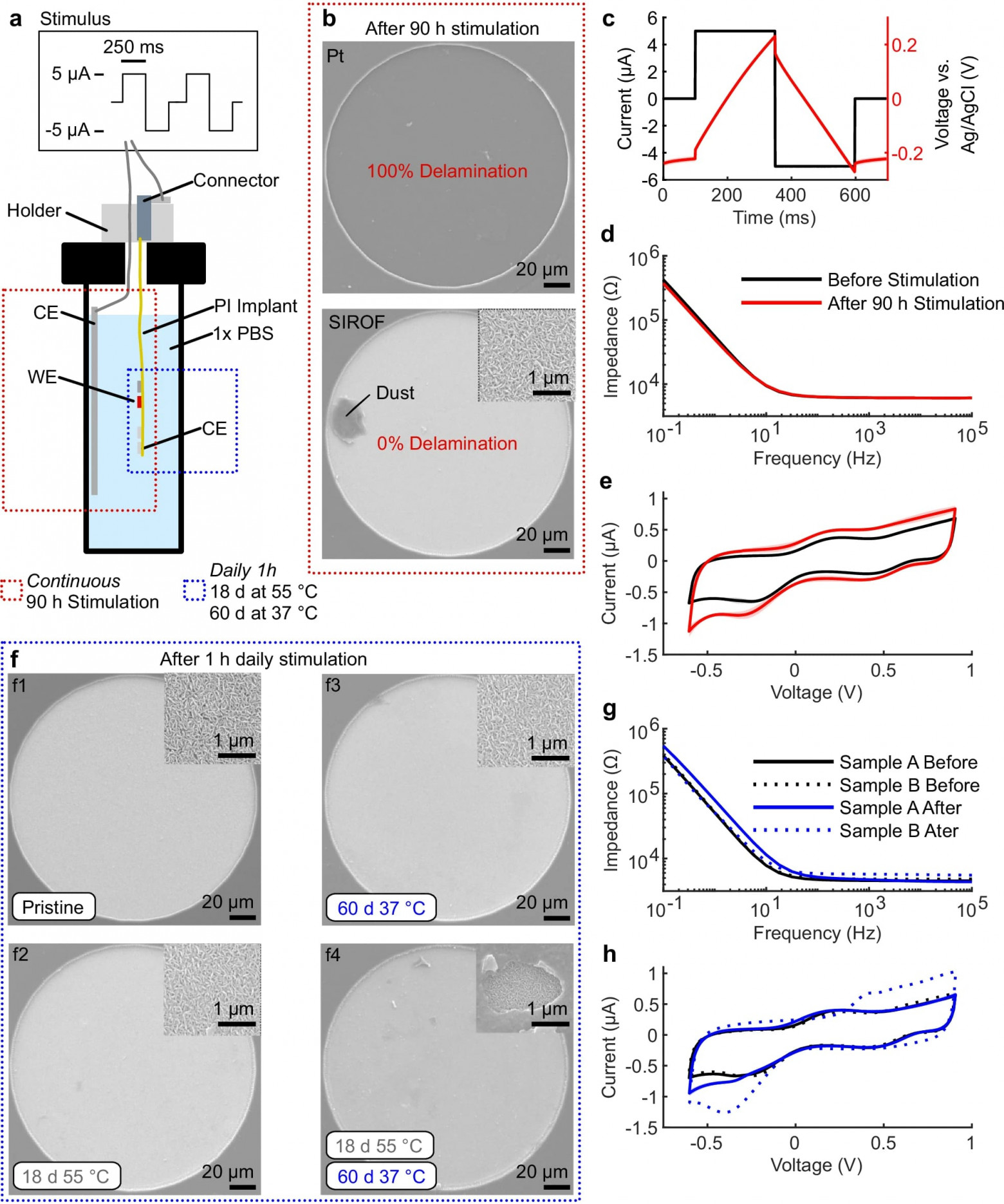
Изображение №5
Чтобы дополнить данные in vivo, ученые исследовали стабильность электродов SIROF в 1х фосфатно-солевом буфере (PBS от phosphate-buffered saline), который имитирует проводимость и состав CSF. Чтобы проверить пригодность электродных материалов для выбранных параметров стимуляции и длительных периодов лечения, было выполнено сравнение производительности электродов, покрытых SIROF, с контрольными электродами Pt. Электроды Pt имеют очень ограниченную псевдоемкостную емкость инжекции заряда по сравнению с SIROF, а покрытие Pt SIROF значительно улучшило стабильность электрода. После 90 часов непрерывной стимуляции в PBS с теми же параметрами импульсов, которые использовались in vivo (5a), электрод стимуляции Pt и соседние электроды стимуляции и регистрации расслаивались и растворялись, тогда как электроды SIROF оставались неповрежденными (5b), что подтверждено с помощью визуализации высокого разрешения, циклической вольтамперометрии (CV от cyclic voltammetry) и электрохимической импедансной спектроскопии (EIS от electrochemical impedance spectroscopy). Переходные напряжения во время стимуляции оставались в пределах водного окна (5c). Постстимуляционный CV показал более высокие пики, чем до стимуляции, вероятно, из-за вызванной стимуляцией гидратации SIROF (5d, 5e). 90-часовой тест непрерывной стимуляции применял больший электрохимический стресс, чем условия in vivo, где стимуляция в общей сложности составляет приблизительно 60 часов в течение 12 недель с периодами восстановления между ними. Несмотря на этот повышенный стресс, электроды SIROF сохраняли свою стабильность.
Для долгосрочной in vivo оценки электродов SIROF ученые ежедневно применяли 1-часовую стимуляцию к паре электродов на образце импланта A в условиях ускоренного старения (55 °C в течение 18 дней, что эквивалентно 62 дням при 37 °C). После этого вторая пара электродов на образце импланта A стимулировалась в неускоренных условиях (37 °C в течение 60 дней). В каждой настройке один электрод служил рабочим электродом (WE от working electrode) в течение 1 часа, затем другой, с четырьмя электродами, закороченными в качестве противоэлектродов (CE от counter electrode). На протяжении всех испытаний поверхности WE (5f), EIS и пики CV оставались стабильными (5g, 5h), что указывает на постоянную производительность электрода.
Однако CE со временем продемонстрировали изменения поверхности, при этом типичная морфология волокон SIROF стала скрытой более плотным слоем материала (5f4). Важно отметить, что измерения CV и EIS подтвердили, что CE оставались функциональными, хотя повышенный резистивный компонент предполагал, что был отложен новый поверхностный слой. Для дальнейшего изучения этого эффекта был протестирован дополнительный набор электродов на образце импланта B, имитируя стимуляцию in vivo путем закорачивания двух электродов как CE и стимуляции одного электрода как WE в течение 1 часа ежедневно в течение 60 дней при 37 °C. Подобно предыдущим экспериментам, электроды оставались функциональными, но на этот раз отложенный слой имел место на WE. Химический анализ показал, что был отложен углерод. Это явление не было далее исследовано в данной работе, поскольку электроды с осажденным углеродом оставались функциональными, а на эксплантированных электродах ничего подобного не наблюдалось.
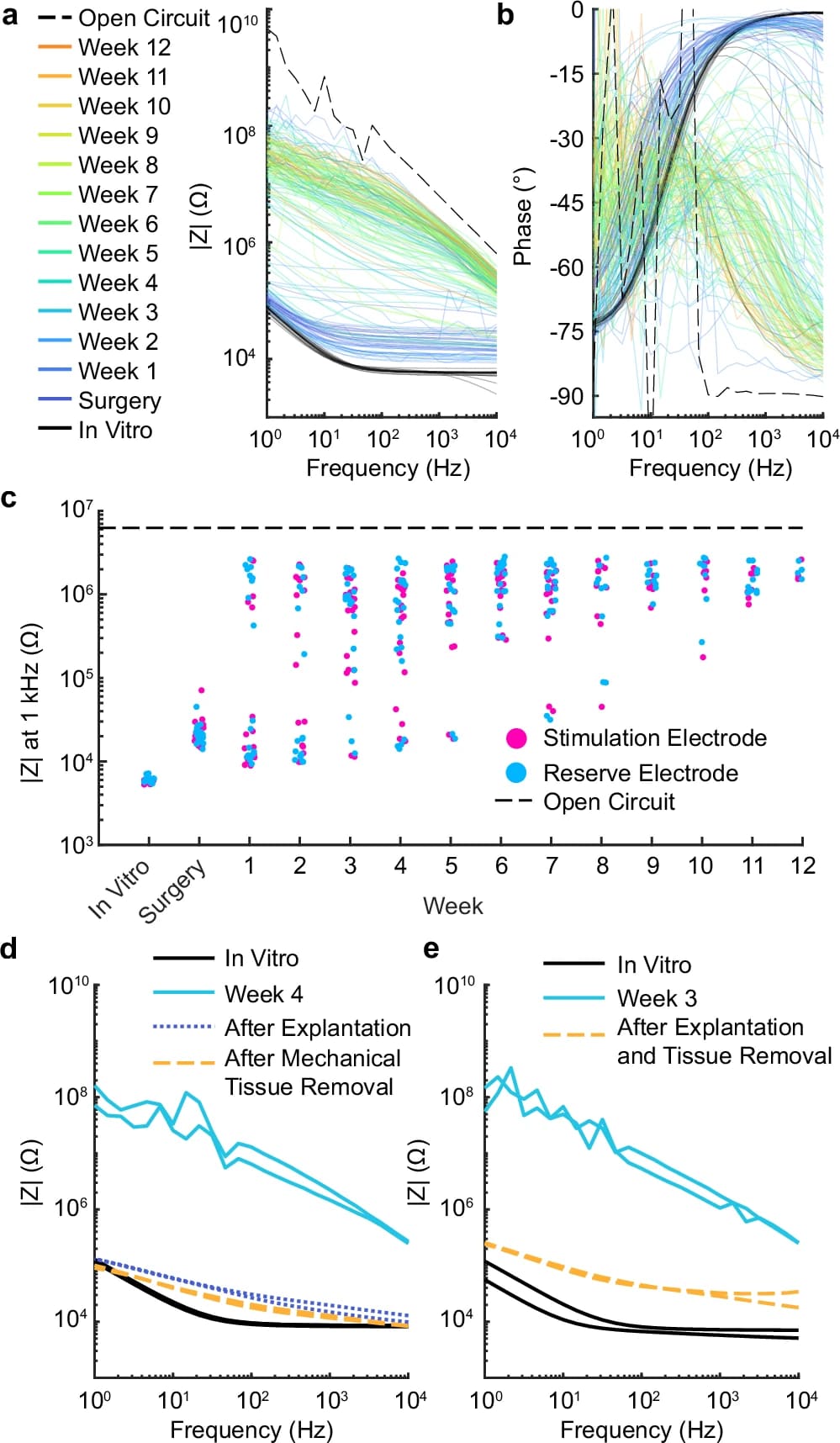
Изображение №6
Для оценки функциональности электродов в группе, получавшей лечение, спектры импеданса регистрировались с двух активных электродов рострально к месту травмы. Четыре закороченных электрода на каудальном конце импланта служили в качестве CE для измерений импеданса. Измерения проводились до имплантации в PBS (in vitro), сразу после хирургической имплантации и еженедельно после этого. Измеренный импеданс увеличивался по всему спектру частот в течение 12 недель стимуляции с контролем тока (6a), в то время как сдвиг фаз предполагал увеличение емкости на более высоких частотах (6b). Несмотря на эти изменения, импеданс никогда не достигал уровней разомкнутой цепи, что указывало бы на отключение электрода; вместо этого EF лечение было бы достигнуто при более высоком напряжении, если бы оно не превышало напряжение соответствия стимулятора (16 В).
Показания импеданса с двух резервных (нестимулированных) электродов на каждом импланте (1a) показали схожие тенденции с течением времени (6c). Разница между окончательным измерением величины импеданса in vivo при 1 кГц для стимулированных и резервных электродов (т. е. электродов, не используемых для стимуляции) существенно не отличалась от 0, что указывает на то, что стимуляция не способствовала различиям в импедансе, наблюдаемым in vivo. Действительно, два устройства, которые были удалены неповрежденными через 3 и 4 недели, показали возвращение импеданса к предимплантационным уровням после механического удаления инкапсулирующей ткани при тестировании в PBS (6d, 6e).
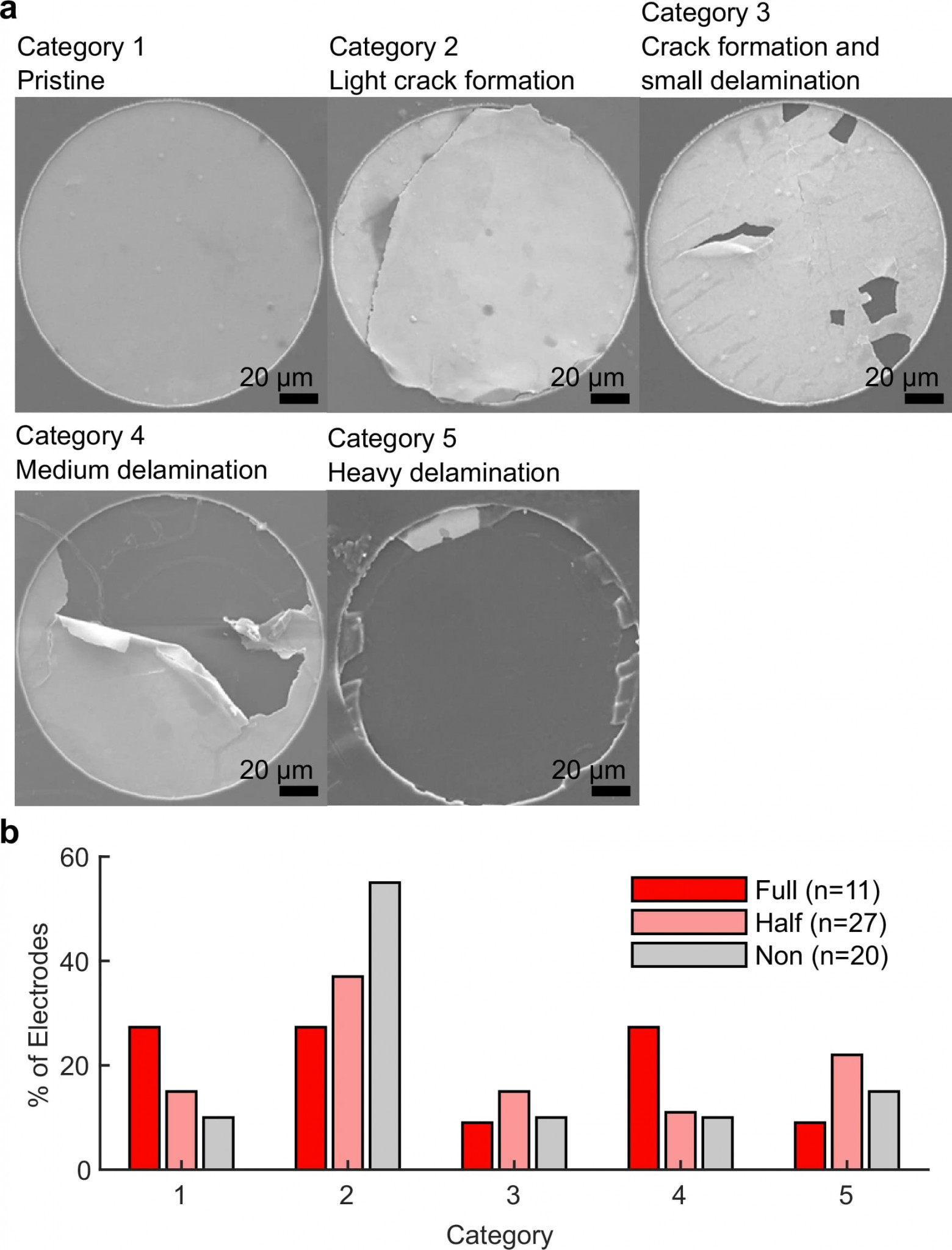
Изображение №7
Хотя полное удаление импланта не было достигнуто через 12 недель, полиимидная секция, взаимодействующая со спинным
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые рассказали о созданном ими электронном импланте, способном стимулировать восстановление поврежденного спинного
Повреждение спинного
Важную роль в развитии и формировании нервной системы на ранних этапах развития организма играет электрическое поле, которое стимулирует и направляет рост нервной ткани вдоль спинного
Во время практических испытаний использовались крысы, которые обладают более развитой способностью к спонтанному восстановлению повреждений спинного
В будущем ученые намерены проверить, как изменения параметров, таки как сила, частота и продолжительность воздействия устройства, повлияют на результат лечения. Это позволит найти оптимальные и наиболее эффективные настройки устройства для реализации лечения повреждений спинного
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Автор: Dmytro_Kikot






